
[12]正解①
(COOH)2・2H2O = 126(g/mol)より、(COOH)2・2H2O は、12.6/126 = 0.1(mol)
また、この中に(COOH)2 も、12.6/126 = 0.1(mol)あります。
水溶液全量が1(L)ですから、シュウ酸(COOH)2 のモル濃度は、
0.1(mol/L) となります。
② 1(mol/L)の塩酸10(mL)に水を加えて1(L)とする、なら正解です。
なら、この問題文も正しいのでは?
まず、1(mol/L)の塩酸10(mL)の密度は1ではないので、10(g)ではありません。
さらに、できた溶液は、10+990=1000(g)ですが、これも密度は1ではないので、1(L)ではありません。
そもそも、ある濃度のモル濃度の溶液を調整する時、溶媒だけの体積や質量を量って加えるということはしません。
③ pH = 2 にしたいということは、[H+]=10-2(mol/L) にすればいいのですから、これは正しいのでは?
いいえ。
0.1(mol/L)の H2SO4 中の [H+]は、0.2 (mol/L)ですから、これを10倍に薄めると、0.02 = 2 × 10-2 (mol/L)となり、pH は 2 より小さくなります。
④ 100(g)の水酸化ナトリウムに水を加えて1000(g)とすれば、正しい文章です。しかし、できる溶液の密度は 1 ではないので、水を加えて1(L)にすると1000(g)にはなっていません。
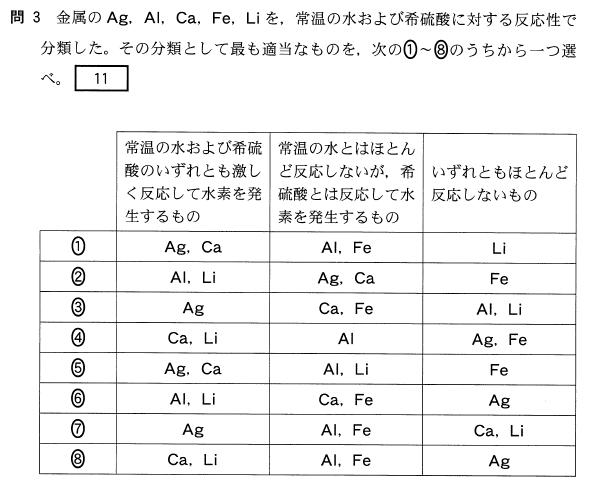
[11]正解⑧
水にも希硫酸にも反応する金属は、上記では、Ca、Li だけです。
水とは反応しないが、希硫酸には反応する金属は、上記では、Al、Fe だけです。
水にも希硫酸にも反応しない金属は、上記では、Ag だけです。

[13]正解①
酸の濃度をa(mol/L)とすると、この酸の中のH+ は、
a(mol/L) × x/1000 (L) × n = axn/1000 (mol) です。
同様に、塩基の水溶液の中のOH- は、
c(mol/L) × y/1000 (L) × m = cym/1000 (mol) です。
酸、塩基が過不足なく中和する時、H+(mol)= OH-(mol) ですから、
axn/1000 = cym/1000
これを a について解くと、
a = cym/xn (mol/L) となります。

[14]正解②
塩酸中の溶質HClは、HCl → H+ + Cl- と電離していて、これらのイオンが電気を導きます。
①水酸化バリウムBa(OH)2は、2価の塩基です。
③ブレンステッド・ローリーの酸の定義そのものですね。
④常温の中性溶液中では、[H+] = [OH-] = 10-7(mol/L)です。
⑤弱塩基の塩である塩化アンモニウムに、強塩基を加えると、弱塩基であるアンモニアが追い出されて発生します。
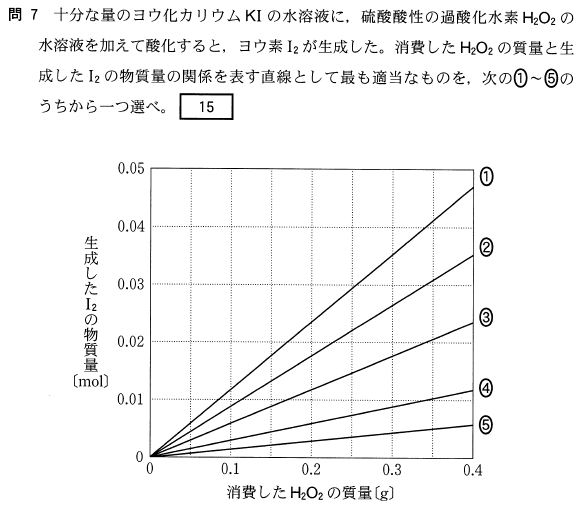
[15]正解④
この時の反応は、KI 中の I- の電子が H2O2 に取られる酸化還元反応です。
2I- → I2 + 2e-
H2O2 + 2H+ + 2e- → 2H2O
の2式を足すと、下式が得られます。
H2O2 + 2H++ 2I- → I2 + 2H2O
この式から、反応した H2O2 と、生じた I2 の比は、
H2O2 : I2 = 1(mol) : 1(mol) = 34(g) : 1(mol) となりますね。
よって、H2O2 , I2 = 0.(g) , 0(mol) と、H2O2 , I2 = 0.34(g) , 0.01(mol) の2点を通る④が正解です。

[1]正解⑤
酸素の同素体には、酸素O2、オゾンO3が存在します。
①炭素の同素体は、ダイヤモンド、黒鉛、それにフラーレンを覚えておきましょう。
②黒鉛は電気を導きます。(電極や抵抗体に用いられています)
③リンの同素体には、黄リン、赤リンがあります。
④硫黄の同素体には、斜方硫黄、単斜硫黄、ゴム状硫黄があり、ゴム状硫黄にはゴムのような弾力性があります。
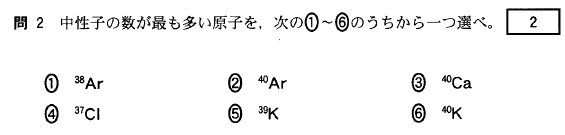
[2]正解②
①Arは原子番号18で陽子数も18です。質量数38ですから、中性子数は、38-18=20
②陽子数は18、質量数40ですから、中性子数は、40-18=22
③Caは原子番号20、陽子数20です。質量数40ですから、中性子数は、40-20=20
④Clは原子番号17、陽子数17です。質量数37ですから、中性子数は、37-17=20
⑤Kは原子番号19、陽子数19です。質量数39ですから、中性子数は、39-19=20
⑥陽子数は19、質量数40ですから、中性子数は、40-19=21
よって、②が最も多い
※原子番号を覚えておかないと解けませんが、周期表の暗記で、H~Caまでは順番に覚えていますよね。これで大丈夫です。(BrやXe等の原子番号が必要になるのは2次試験の時だけです)
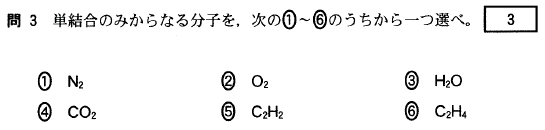
[3]正解③
H-O-H と、単結合のみでつながっています。(なお、形は折れ線型です)
① NΞN 三重結合のみ
② O=O 二重結合のみ
④ O=C=O 二重結合のみ
⑤ H-CΞC-H 単結合と三重結合
⑥ H2C=CH2 (H2C間は単結合が2つある)単結合と二重結合

[4]正解①
①は、外観からイオン結晶っぽく見えるんでしょうか? 二酸化ケイ素は2つの非金属元素が共有結合で次々につながった「共有結晶」の仲間です。
イオン結晶は、金属元素と非金属元素が結合(イオン結合)した物質です。あと、金属元素を含みませんがアンモニウム塩もイオン結晶です。②③⑤⑥はすべて金属元素と非金属元素の組み合わせですね。
[5]正解③
3原子分子ですが、O=C=O と、原子が一直線に並んだ分子です。
① 正四面体型
② 折れ線型
④ 三角すい型