第2問
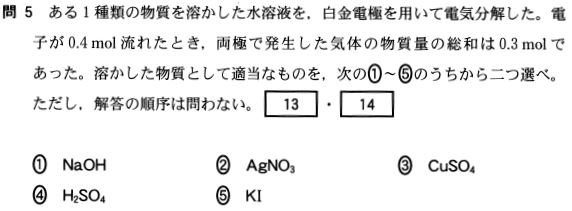
答①、④
①、④は、水の電気分解で、陰極H2、陽極O2が発生。
②、③は、陽極O2発生。
⑤は、陰極H2発生。
まず、①、④について考えると 2H+ + 2e- → H2
0.4mol 0.2mol
この時発生するO2はH2の1/2なので、0.1mol発生
よって、①、④では気体が 0.2 + 0.1 = 0.3mol発生
②、③では、O2が0.1mol発生
⑤では、H2が0.2mol発生
第2問
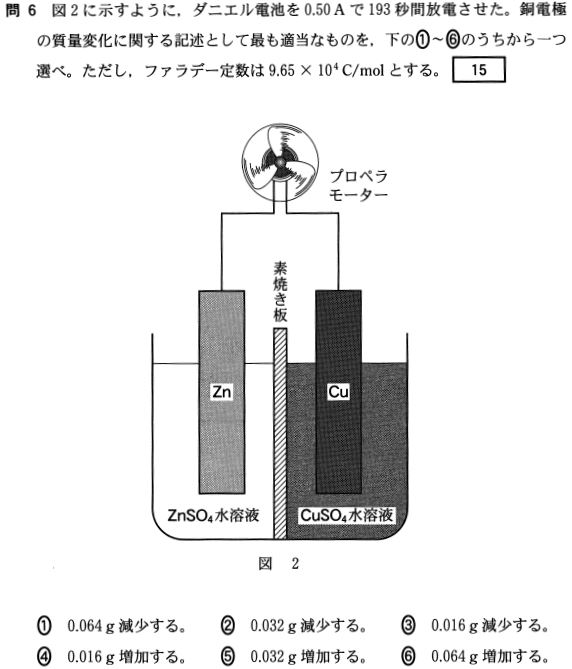
答⑤
流れた電子は
Q = It = 0.5 × 1930(C) → 0.5 × 1930/96500 = 0.001mol
正極のCu極板では
Cu2+ + 2e- → Cu の反応が起こるから
0.001 × (1/2) × 64 = 0.032g 増加
第3問

答③
電気伝導性が1番高いのは、銀。
銅の電気伝導性は、2番目です。
第3問

答④
基本ですね!
H2O2 の O の酸化数は-1
第3問

答③
塩化アンモニウムに強塩基を加えて、弱塩基であるアンモニアを追い出します。
第3問

答④
Zn2+にアンモニア水を加えると、Zn(OH)2の白色沈殿が生じ、過剰のアンモニア水を加えるとこの沈殿は溶解する。
Al3+にアンモニア水を加えると、Al(OH)3の白色沈殿が生じるが、過剰のアンモニア水を加えてもこの沈殿は溶解しない。
第3問

答①
実験Ⅰでは、酸化作用により、銅が酸化されて溶ける。
実験Ⅱでは、不揮発性酸である濃硫酸が揮発性酸である塩化水素を追い出す。
第3問

答①
CuSO4 + BaCl2 → BaSO4
で、BaSO4 2.33g は 2.33/233 = 0.01mo l なので、反応した CuSO4 も 0.01mol
0.01mol の CuSO4 は、160 × 0.01 = 1.6g
よって、最初の硫酸銅(CuSO4・nH2O)中のH2Oは、1.78-1.6=0.18g で 、これは、0.18/18 = 0.01mol
CuSO4 0.01mol に H2O 0.01mol が結合しているので、
n=1となる。
第3問
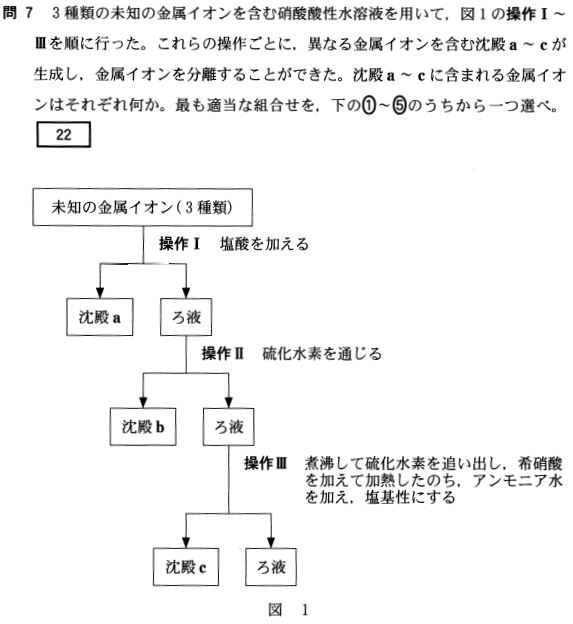
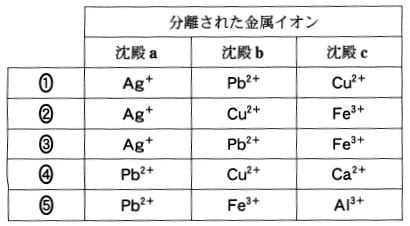
答②
操作Ⅰでは、Ag+、Pb2+ が考えられるが、「操作ごとに、異なる金属イオンを含む沈殿a~cが生成し、」とあるので、
操作ⅠではAg+が適当。(Pb2+だと、操作ⅡにもPb2+を含む沈殿が生じてしまう)
操作Ⅱでは、Cu2+、Pb2+が沈殿を生じるが、上に記した通りPb2+は不適。よってCu2+
操作Ⅲでは、Fe3+が適当である。
第4問
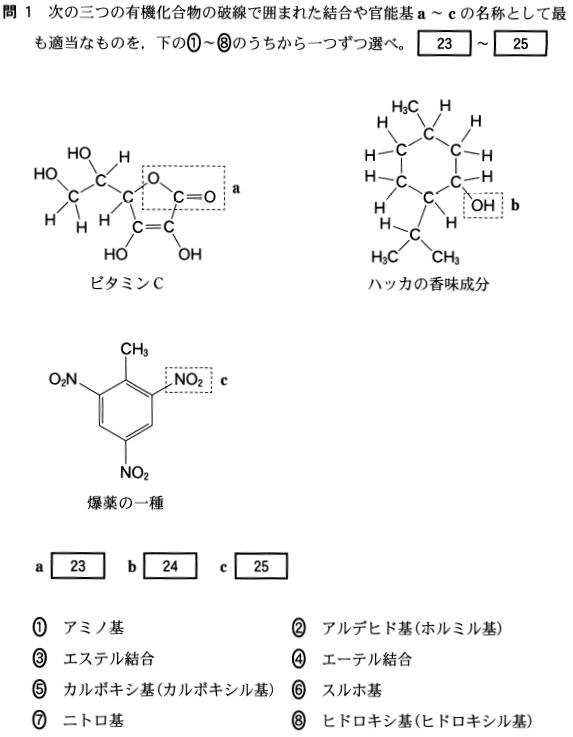
答23③
答24⑧
答25⑦
基本ですね!! (見慣れない化合物に惑わされないように)