
[5]正解①
弱酸と弱酸の塩の混合溶液は、緩衝液となります。
また、溶液中に酢酸CH3COOH、酢酸ナトリウムCH3COONa、どちらも、0.1(mol/L)× 0.1(L)= 0.01(mol)存在しています。
a.(正) 酢酸ナトリウムCH3COONaは水溶性のイオン結合性物質なので、水中でほぼすべて電離しています。
b.(正) 酢酸は弱酸でほとんど電離しないので、CH3COOHは0.01(mol)存在しています。また、上記a.の通りCH3COONaはほぼ完全電離で、CH3COONa → CH3COO- + Na+ ですから、CH3COO- も 0.01(mol)存在すると考えます。
c.(正) この混合溶液中には、CH3COOH、CH3COO- 、Na+ が大量に存在しています。この溶液中に H+ を加えると、CH3COO- + H+ → CH3COOH の反応により H+ が消費されるため、H+ はほとんど増加せず、pHもほとんど変化しない、と考えます。
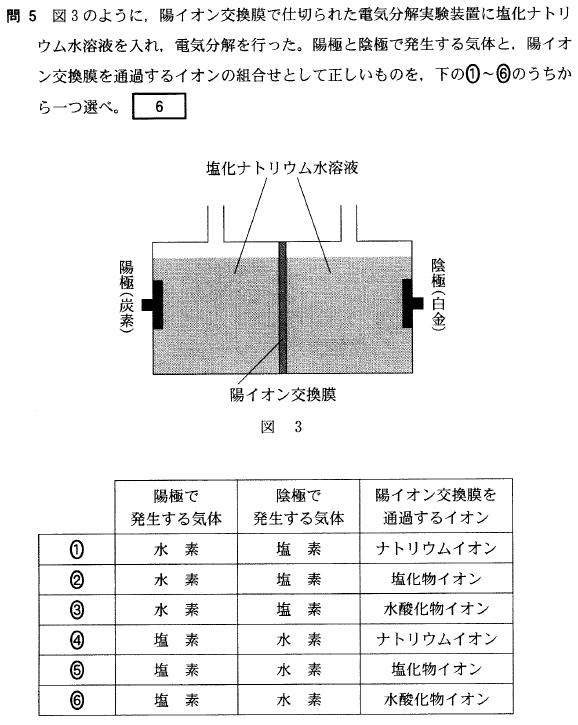
[6]正解④
左右それぞれの電気分解曹では、 NaCl → Na+ + Cl- のように電離していて、
これら Na+ 、Cl- が電極に引き付けられます。
陽極(+極)には、 Cl- が引き付けられ、2Cl- → Cl2↑+ 2e- で、塩素が発生します。
陰極(-極)には、Na+ が引き付けられますが、Na+ はイオン化傾向が大きいため電子を受け取らず、代わりにH2Oが電子を受け取り、2H2O + 2e- → H2↑+ 2OH- で、水素が発生します。
さて、陽極では、Cl- と Na+ が同数存在して電荷が釣り合っていたのですが、Cl- が減ったので、「Na+ が余っている状態」と考えて下さい。
同様に、陽極では、Cl- と Na+ が同数存在して電荷が釣り合っていたのですが、OH- が増えたので、負電荷 が余っている状態つまり「正電荷 が足りない状態」と考えて下さい。
これら、陰極の「Na+ が余っている状態」、陽極の「正電荷 が足りない状態」は、「陽極から陰極に、陽イオン交換膜を経て Na+ が移動する」ことで解消される、と考えて下さい。(陰極から陽極に、陰イオンが移動してもこの状態を解消できますが、陽イオン交換膜は陽イオンしか通せないので、陽イオンが移動する訳です)

[7]正解②
SO2はH2Sと酸化還元反応を起こし、この時SO2は酸化剤として働きます。(通常SO2は還元剤として働く事が多いのですが)また、この時の反応式は、
SO2 + 2H2S → 2H2O + 3S です。
さて、H2Sは 0.01(mol/L)× 0.2(L)=0.002(mol)あります。
これに SO2 を、14/22400 = 0.000625(mol)反応させますが、この SO2 と反応するH2Sは、反応式より、
0.000625 × 2 = 0.00125(mol)です。
よって、反応せずに残ったH2Sは、
0.002 - 0.00125 = 0.00075 = 7.5 × 10-4(mol) となります。

[1][2]正解①⑥
鉛の最大酸化数は+4(代表例PbO2)です。また、次亜塩素酸HClOは強い酸化作用を持ちます。
②粘土は、セメント、陶磁器の原料です。
③ガラス中の構成粒子の配列は不規則です。構成粒子の配列が不規則な固体をアモルファス(非晶質、非結晶)と呼びます。
④セラミックスは金属の酸化物などを焼結したものですが、ファインセラミックスは製造工程を精密に制御して作られ、出来た物質の機能も優れている(ファイン)ため、このような名称で呼ばれます。
⑤空気中で生じる銅のサビは緑青と呼ばれています。(成分は塩基性炭酸銅と言われてきましたが、最近は塩基性硫酸銅が主成分だと言われています)

[3]正解②
ハーバー・ボッシュ法では、窒素と水素を、高温、高圧で反応させます。
①Fe触媒下でベンゼンに塩素を作用させると塩素化が起こります。光を当てながらベンゼンに塩素を作用させると付加反応が起こりますので、これと混同しないように。
③接触法の触媒V2O5を用いて、SO2を空気(酸素)で酸化してSO3を得ます。これを水に溶かす反応は進行が遅いので、SO3を濃硫酸に吸収させて、希硫酸で薄めて濃硫酸を得る、という方法によっています。
④オストワルト法の触媒Ptを用いて、NH3を空気(酸素)で酸化してNOを得ます。これをさらに酸化してNO2を得て、これを水に溶かして硝酸HNO3を得ます。
⑤自動車排気ガス中の、燃焼しなかった炭化水素CXHY、窒素酸化物NOXは、ロジウム、パラジウム、白金等の貴金属を触媒として、CO2、N2、H2Oに分解、無害化してから大気中に放出します。

[4]正解⑤
AのNO2は水に溶けやすく、BのNOは水に溶けにくいので、A、Bの混合気体を水に通すと、気体Bだけが得られてしまうので、目的に反しますね。
①AのCOは水に溶けにくく、BのHClは水に良く溶けるので、気体Aだけが得られます。
②AのO2は石灰水とは反応せず、BのCO2は石灰水Ca(OH)2と反応して沈殿となって除かれるので、気体Aだけが得られます。(O2が水に溶けにくいことももちろんありますが)
③AのN2はNaOHとは反応せず、BのSO2はNaOHと反応して塩となって除かれるので、気体Aだけが得られます。(酸性酸化物が塩基と反応して塩を作る)
④AのCl2は濃硫酸とは反応せず、Bの水蒸気H2Oは濃硫酸に吸収されて除かれるので、気体Aだけが得られます。(濃硫酸には吸湿作用がある)

[5]正解⑦
黄銅中の金属Cu、Znがすべて溶け(Cu2+、Zn2+になり)、これと硫化水素H2Sが反応して沈殿が生じるという流れです。酸性溶液中でH2Sが吹き込まれていることに注意しましょう。
さて、酸性溶液中でH2Sを吹き込んだ時、Cu2+はCuSの沈殿を生じますが、Zn2+は沈殿を生じません。よって、沈殿はすべてCuSということになります。
反応する物質量の関係は、Cu → Cu2+ → CuS ですから、
黄銅中のCuと沈殿CuSのmol比は 1:1 です。
生じたCuSは、19.2/96 = 0.2(mol)で、黄銅中のCuも 0.2(mol)です。
このCuの質量は、64 × 0.2(g)ですから、もとの黄銅 20(g)中の質量%は、
(64 × 0.2)/20 × 100 = 64(%) となります。

[6]正解②
MnO2とHCl(濃塩酸)を混合して加熱すると、塩素Cl2が発生します。
反応式は、MnO2 + 4HCl → MnCl2 + 2H2O + Cl2 ↑ です。
反応するMnO2 と Cl2 のmol比は、1:1 ですね。
さて、MnO2 は、1.74/87 = 0.02(mol)ですから、発生するCl2 も0.02(mol)です。
これは標準状態で、22.4(L)× 0.02 = 0.448(L)ですから、②の0.45(L)が正解です。
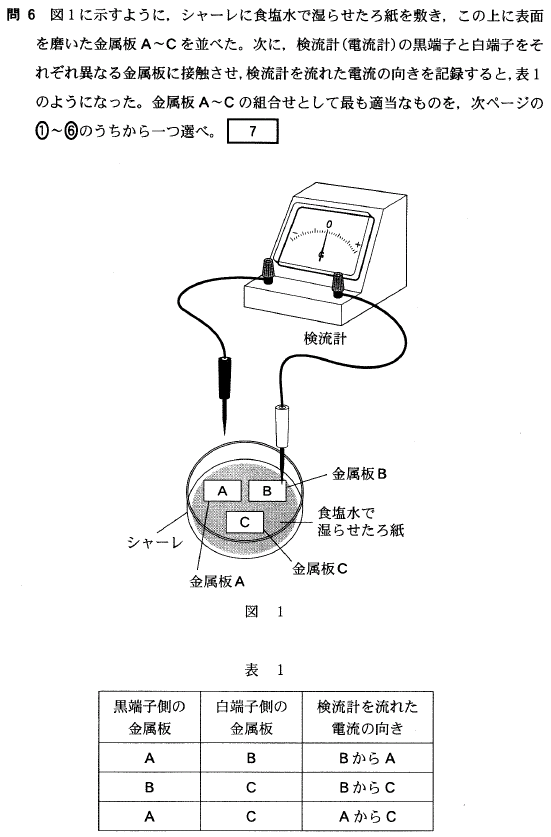

[7]正解⑥
検流計を流れる電流の向きに注目します。
「BからAに電流が流れた」ということは、Aが負極、Bが正極ということになりますね。「AからBに電子が流れた」とまず考えてもいいでしょう。
ということは、イオン化傾向は、A>Bとなります。
童謡に、残り2つの結果から、C>B、C>A 、が分かります。
以上より、イオン化傾向の大小は、C>A>B 、ですね。
さて、解答の一覧を見ると、金属板は、銅Cu、亜鉛Zn、マグネシウムMg、の3つです。
この3つは、イオン化傾向の大きな順にすぐに並べられますね。
Mg>Zn>Cu です。
よって、CはMg、AはZn、BはCu、となり、⑥が正解になります。

[1]正解①
エチレンに水が付加するとエタノールができますが、アセチレンに水が付加するとアセトアルデヒドができます。
②エチレンが付加重合するとポリエチレンができ、アセチレンが付加重合するとポリアセチレンができます。どちらも高分子化合物です。
③水素を付加すると、エチレンC2H4→エタンC2H6、アセチレンC2H2→エチレンC2H4→エタンC2H6、と変化します。
④エチレン中の原子は同一平面上、アセチレン中の原子は同一直線状に配置されますので、この文書は正しいです。(同一直線状配置なら、同一平面上配置と言って良い)
⑤エチレン、アセチレン、どちらも水に溶けにくい気体なので、水上置換で捕集します。