金属のイオン化傾向、覚えやすいでしょう?
「貸そうかな、まあ、あてにすんな、ひど過ぎん借金 (にしといてね)」
この語呂合わせはわりとマシな感じしませんか?
「K、Ca、Na」は、「借りようかな」の方がいいかも。すると「借りようかな、まあ、あてにすんな、ひど過ぎん借金」となります。好きなほうで覚えて下さい。
さて、本題に入りましょう。
これを覚えたあと、それぞれの金属ごとの反応性を頭に入れる必要があるんですが、
「細かいところまでなかなか覚えきれない!」とか「この金属は塩酸に溶けたっけ?」とか、いつまでもすっきりしないことがあると思います。
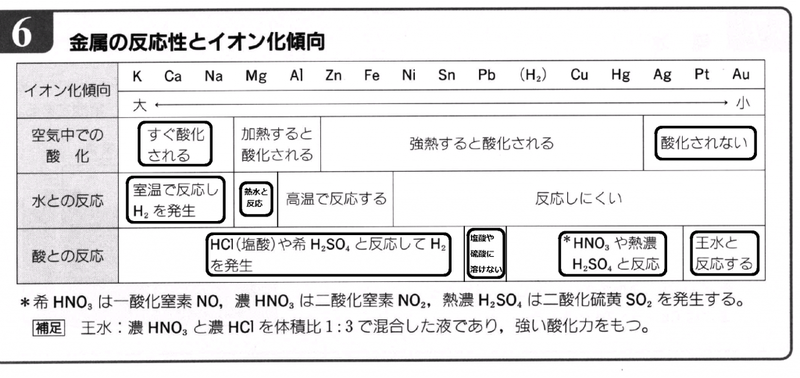
さて、入試でよく出題されている項目を念頭にまとめてみましょう。
ここだけは絶対に押さえて欲しいという個所を太枠で囲っておきました。
①K、Ca、Na は水と即反応、溶けてH
2発生します。ですから、空気中でも即酸化されます。
②Ag、Pt、Au は空気中では酸化されません。錆びないし、加熱しても酸化されません。貴金属ですから!
③Mg は熱水と反応、溶けてH
2発生します。(熱水じゃないと反応しないのはMgだけです)
④(H
2)よりイオン化傾向が大きい金属つまり、「~まああてにすんな」までの金属は塩酸、希硫酸に溶けてH
2発生です。
⑤ ④のうちのPbだけは、塩酸、希硫酸に溶けにくいんです。溶けないと覚えましょう。(この時生じるPbCl
2、PbSO
4が水に不溶性で反応が進まないためです)
⑥(H
2)よりイオン化傾向が小さい金属つまり、「~ひどすぎん借金」までの金属は酸化力の強い酸でないと溶けません。(塩酸、希硫酸には酸化力ないから溶けないんです)
ア)Pt、Au は、酸化力最強の王水だけに溶けます。
イ)Cu、Hg、Ag は、硝酸、熱濃硫酸に溶けます。
※Cu(またはAg) + 希HNO
3 → Cu
2+(またはAg+) + NO↑
Cu(またはAg) + 濃HNO
3 → Cu
2+(またはAg+) + NO
2↑
Cu(またはAg) + 濃H
2SO
4 → Cu
2+(またはAg+) + SO
2↑
(この3つの反応の完全な化学反応式は、2次試験受験の人は覚えて下さいね)
※王水は「1升3円」と覚えよう。濃硝酸と濃塩酸を、体積比で1:3の割合で混合して作ります。


