2次試験
この問題を解説していて、ちょっとスムーズにいかない所がありました。
複雑な問題ではありませんが、出来るだけわかりやすく解説しないと、
細部にはまり込んで全体が見渡せなくなってしまいます。(いつでもそうですが)
このことを反省して、解説を記録しておこうと思います。

<解説>
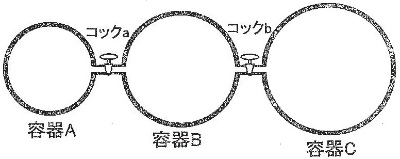
[ケ]
コックaを開くと、容器の体積は3倍(3V1/V1)になるので、
窒素の圧力は、1/3になる。
P1 × 1/3 = P1/3
[コ]
容器B中の窒素の物質量nは、
n = PV/RT
= (P1/3)2V1/RT1
= 2P1V1/3RT1
[サ]
[ケ]と同様に、全コックを開いた後の水素の分圧を求めると、
P1 × 3/6 = 3P1/6
また、窒素の分圧は、[ケ]からさらに容器の体積が2倍(6V1/3V1)になるので、
P1/3 × 1/2 = P1/6
∴全圧は
3P1/6 + P1/6 = 4P1/6 = 2P1/3
[シ]
容器C(H2)は容器A(N2)に対して体積が3倍で、またどちらも同圧なので、
N2とH2の物質量は、反応前 m、3m とおける。また、反応分を x、3x とおくと、
N2 + 3H2 → 2NH3
反応前 m 3m
反応分 -x -3x +2x
反応後 m-x 3m-3x 2x
反応後気体計(4m-2x)mol、NH3 2xmol で、NH3のモル分率1/3より
2x/(4m-2x) = 1/3
∴NH3の物質量 2x = mモル
ここで、mは反応前のN2の物質量と等しいから、
m=PV/RT
= P1V1/RT1
[ス]
反応後気体計 4m-2x = 4m-m = 3mモル
気体mモルに相当する圧力は、全コックを開けた時のN2の分圧 P1/6 と同じなので
反応後の全圧 = 3 × P1/6 = P1/2
[セ]
反応後の水素 3m-3x = 3m-3m/2 = 3m/2モル
[ス]と同様にして反応後の水素の分圧 = 3/2 × P1/6 = P1/4
センター試験
熱化学の勉強で
反応熱 = 生成物の生成熱の総和 - 反応物の生成熱の総和
が教科書に載っています。
これについての解説は教科書には載っていないのですが、
受験勉強には欠かせない特効薬の一つです。
略して「右-左の式」として教えています。
今年のセンターにもこれで即答できる問題が1問ありました。
さて、何故この式だと言えるのでしょうか?
また、東進予備校の解説にあった
反応熱 = 反応物の燃焼熱の総和 - 生成物の燃焼熱の総和
の式も、なぜ言えるのでしょうか?
今回のセンター試験の問題を題材にして考えてみましょう。
エチレンC2H4とエタノールC2H5OHに関する熱化学方程式
C2H4 + H2O = C2H5OH + QkJ ・・・(ア)
について、下の図を見て下さい。
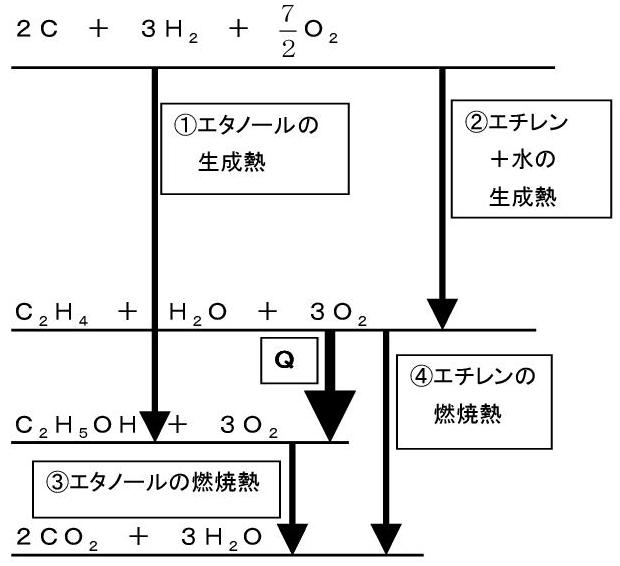
前回、「C2H4 + H2O」 と「C2H5OH」のの化学エネルギーの順位はわからないと書きました。
そこで資料で調べたのですが、C2H4の燃焼熱の方がC2H5OHの燃焼熱より大きい事がわかりましたので、上の図のような関係になります。
このエネルギー図を見れば、上式(ア)の反応熱Qは、
①-② つまり 「生成物の生成熱の総和 - 反応物の生成熱の総和」 が明らかです。
また、④-③ つまり 「反応物の燃焼熱の総和 - 生成物の燃焼熱の総和」 になることも明らかです。
考えてみると、生成熱は単体からの反応熱ですから、エネルギー図では単体は化合物の上になります。(例外はありますが)
一方、燃焼は例外なく発熱なので、エネルギー図では燃焼生成物は化合物の下になります。
あとは、上のようなエネルギー図を描いてみれば明らかですね。
さて、ここで提案です。
「生成熱なら右-左(単体以外)」!
「燃焼熱なら左-右(燃焼物以外)」!
と覚えたらどうでしょう?
自分なりの問題の解説は、試験当日夜に書きましたが
予備校の解説はどうだったでしょう?
今回、昨年が易しかったこともあり、難化を期待していたのですが
(ごめんなさい! 頑張った受験生にとっては有利なので)
易しい問題ばかりでした。焦らせる問題は3題だけ?
有機化学は構造推定も、異性体も出題されませんでした。
官能基の名称を尋ねるだけの問題が3問も・・・。
問題数33題は初めてでしたが、時間足りない、とはならなかったと思います。
また、このレベルの問題でなけれはならない(狙った平均点になるように)ということが、
現在の受験生の理科の力を表していると考えると、
教える側は、生徒の実力を回復させることを考えるべきなのでしょう。
さて、東進の解説を見てみましょう。
まず、第1問の問6「5」ですが、
やはり、このやり方の方がわかり易いですね。
酸素Oが37%で、金属Mが63%だから、
63/55 : 37/16 ≒ 1 : 2
∴MO2
とやった方が早いですね。
次は、第2問の問2「9」です
これでは説明になっていません。
①反応熱=「生成物の生成熱の和」-「反応物の生成熱の和」
は教科書に載っていますが、
②反応熱=「反応物の燃焼熱の和」-「生成物の燃焼熱の和」
は教科書に載っていません。
つまり、②を知っていないと解けないわけです。
予備校では、②も教えているようですね。
次、第2問の問6「12」です
こんな感じの説明になるでしょう。
電解液も負極の分だけしか考えなかったと言っていた受験生がいました。
さて、第3問の問1「15」ですが
これは焦らせる問題ではありません。
教科書にも載っていますし、CaF2と濃硫酸を混ぜて加熱。
これでOKなんですが、ちょっとだけ疑問が。
CaF2と濃塩酸では本当に反応は起こらないんでしょうか?
CaF2 + 2HCl → CaCl2 + 2HF
これ、強酸による弱酸の追い出し反応と判定でき、起こるような気がしませんか?
しかし、HFは水に溶けやすそうだし、加熱も必要でしょう。
すると、HClも一緒に出てきてしまいます。HFからHClだけを取り除くのは大変そうです。
一方、CaF2と濃硫酸なら、濃硫酸からは揮発成分は発生しませんから、濃硫酸を使った方が明らかにいいでしょうね。
でも、反応が起こるか起こらないかと聞かれれば ・・・
ただ、この部分は受験生に気にして欲しい部分ではありません。
受験問題には、正解なのに実際の反応は起こらない、というものがありますから・・・
ただ、「受験用の知識なんだよ」で済ませるのは、
探究心のある子に対してはちょっと申し訳ない気もするんです。
あとの問題は、いつも通りの解説であったと思います。
さて、平均点ですが、大学入試センター発表によると
64.40 で 昨年比 -0.73 という結果になりました。
自分はもう少し低いかもしれないと思っていました。
ともかく、2013年度本番向けの勉強は終わりましたが、
休む間もなく、2次試験向けの勉強を数名で続けています!
最後まで全力で頑張って欲しいと強く思っています!
頑張って!!
センター試験
センター試験
2013センター化学本試.pdf
「24」「25」「26」教科書そのまま!
「27」いつも通り。
シクロアルケンの一般式は、CnH2n-2
「28」いつも通り。
③はベンゼンっぽく見えるが、マレイン酸と分かったでしょうか?
「29」いつも通り。
「30」いつも通りだが、グラフでの出題。
常温でC4H10ブタンは気体。炭素数5以上から液体になる。
「31」いつも通りだが、このような設問は初めて。しかし簡単。
「32」いつも通り。
④アンモニア水が少ないと、Ag2O(暗褐色)の沈殿を生じる。
アンモニア水が多いと、[Ag(NH3)2]+(無色)の溶液になる。
これが銀鏡反応の試薬となる溶液。(アンモニア性硝酸銀溶液)
「33」いつも通り。
酢酸エチルCH3COOC2H5 88gは1モル。
これは酢酸1モルから生成するので
1/2.0 × 100 = 50%
センター試験
2013センター化学本試.pdf
「15」いつも通り。
フッ化水素の発生は、不揮発性酸による揮発性酸HFの追い出しによる。
強酸HClによる弱酸HFの追い出し、と勘違いさせるやや意地悪な問題。
「16」いつも通り。
ケイ素は二酸化ケイ素を還元して得る、はあまり出てこなかったので迷う?
「17」「18」いつも通り。
ここでは、両性酸化物2種を選ぶのではなく
酸性酸化物と両性酸化物を選ぶ。
ここには両性酸化物は1種しかないけど
思い込んでしまうとはまります。
「19」いつも通り。
H2SとI2の反応が起こるなら、H2Sは還元剤にしかならない。
つまり、H2Sは酸化される。
「20」いつも通り。
Cu2+は、酸性、H2SでCuSの沈殿生成
「21」いつも通り。
FeCl3 → Fe(OH)3 → 1/2 Fe2O3
FeCl3は0.008モル、Fe2O3は0.004モル
最後にFe2O3の式量160をかけて答。
「22」いつも通り。
濃硫酸とNaClは塩化水素発生。
「23」いつも通り。
センター試験
2013センター化学本試.pdf
「8」いつも通り。
右-左ですぐ答出る。
「9」これが今回の関門だと思う。
初めてのタイプ。 難問と判定されるのでは?
結論は、エネルギー図を描いてみて下さい。
1番上に C2H4 + H2O(液) + 3O2
その下に C2H5OH(液) + 3O2
その下に 2CO2 + 3H2O(液)
と描いてみると、
C2H4の燃焼熱と、C2H5OH(液)の燃焼熱の差が
答になることがわかります。
これに気づけばあっけないんですが。
熱化学方程式を全部書いていると時間かかりそうです。
「10」いつも通り。
ただ、SnCl2は通常還元剤なので、これに引っかかりそう。
しかもSnCl2はそれほど出題されない。
でも、反応式を落ち着いて見れば簡単。
「11」いつも通り。
⑤は当たり前過ぎて疑うかも。
「12」いつも通り。
水酸化カルシウムは0.001モルで、OH-は0.002モルと進めば、
中和熱0.002モル分、とわかる。
小数点以下けたの多い小さい値の計算は慎重に。
「13」いつもとやや違うパターン。
これが次の関門? でも新しい問題ではない。
1.ある程度放電した、はまったく関係なし
2.充電する時は、外部電池の負極は鉛蓄電池の負極につなぐ
3.充電時、鉛蓄電池の負極は、
PbSO4 → Pb となるので、電子2モルで96g減
4.同時に、電子2モルで、
電解液中の SO42- は、2モルつまり192g増加する。
(負極から1モル、正極から1モル、計2モル増加)
これで答えが出ます。
1.2.4.に気づくかどうかですね。
もう一つ、
(+192mg ,-96mg)の座標を見つけるのに
慣れていなくて、ちょっと戸惑うかも。
「14」いつも通り。
H2O + e- → OH- + 1/2 H2 が書ければ大丈夫。
図が大ヒントなので書けますね。
NaOH = OH- = 1/20 モル。つまり e- も 1/20 モル。
あとは、I × 3600 × 1/96500 = 1/20
∴ I ≒ 1.34(A)
センター試験
2013センター化学本試.pdf
第1問
「1」いつもの練習通り。
「2」いつも通り。<結合に使う>に注意。
「3」いつも通り。
「4」いつも通り。1つの式を立ててから計算した方が絶対に早い。
1400 × 49/100 × 1/98 = 7%
「5」いつも通り。molで比較しよう。
「6」これがいつもとちょっと違う。
M/MOx = 0.63
55/55+16X = 0.63
∴ X ≒2
Xを求めるタイプは初めてで、しかも答えが割り切れないので焦ったのでは。
「7」いつも通り。
ワインが酸化する=エタノールが酸化して酢酸になり酸っぱくなる。