化学1

まず、真面目に解いてみましょう。
流れた電子の物質量(mol)は
3.86 × 104/9.65 × 104 = 0.4(mol)
NaOH → Na+ + OH-
<陰極->
( Na+ + e- → × )
4H2O + 4e- → 4OH- + 2H2↑ ・・・①
<陽極+>
4OH- → 2H2O+ O2↑+ 4e- ・・・②
ここで、陰極と陽極の反応式を1つにまとめると(つまり①+②)
2H2O → 2H2↑ + O2↑
となります。
また、この時流れた電子は4molですね。
電子4molで水2mol分解しています。
4e-⇔ 2H2O
0.4mol 0.2mol
よって、分解するH2O(=18g/mol)は、
18g/mol × 0.2mol = 3.6(g)
次は、センター試験用速攻。
流れた電子の物質量(mol)は
3.86 × 104/9.65 × 104 = 0.4(mol)
また、NaOH 水溶液の電気分解は、水H2Oの電気分解と考えて良い。
2H2O → 2H2↑ + O2↑
ここで、2H2 が出来る時、
4H+ + 4e- → 2H2
と考えて良いので
4e-⇔ 2H2O
0.4mol 0.2mol
よって、分解するH2O(=18g/mol)は、
18g/mol × 0.2mol = 3.6(g)
化学1
教科書の例題より

まず溶液中のイオンを考えると、CuSO4 水溶液ですから
CuSO4 → Cu2+ + SO42-
ですね。
<陰極->
Cu2+ + 2e- → Cu
2mol 1mol
これより、電子e-が2mol流れると、Cuが1mol出来ることがわかります。
ところが、問題では「電子~mol流れた時・・・」とは聞いてきません。
この例題のように「5Aの電流を16分5秒流した時・・・」というように聞いてきます。
ですから、「5Aの電流を16分5秒流すと、電子が何mol流れたことになるか」が分かればOKですね!
ここで、電気量Q(C)について考えてみましょう。
水が流れる時は、
水量 = 水流 × 時間
ですね?
ですから、電気(電子)が流れる時は、
電気量 = 電流 × 時間
Q(C) = I(A) × t(s)
となります。
電気量(C)と電子(mol)の関係は、
96500(C) ⇔ 1(mol)
以上より、
Q = 5 × (16 × 60 + 5)
= 5 × 965(C)
これを電子の物質量(mol)で表すと、
5 × 965/96500 = 0.05(mol)
ここまできたら、もう大丈夫ですね。
Cu2+ + 2e- → Cu
0.05mol 0.025mol
よって、析出するCu(=64g/mol)は、
64g/mol × 0.025mol = 1.6(g)
化学1
電気分解の陰極、陽極で生じる物質は何か? と聞かれた時に、場合分けをして考えなければいけません。
OH-なら分解して、SO42-なら分解せず代わりにH2Oが分解する・・・
量関係の問題も良く出されるので反応式も重要ですね。
「はぁ、これ覚えるのかぁ・・・」と思いませんでしたか?
それでは、入試に出るものに限って、思い切ってまとめてみましょう!!
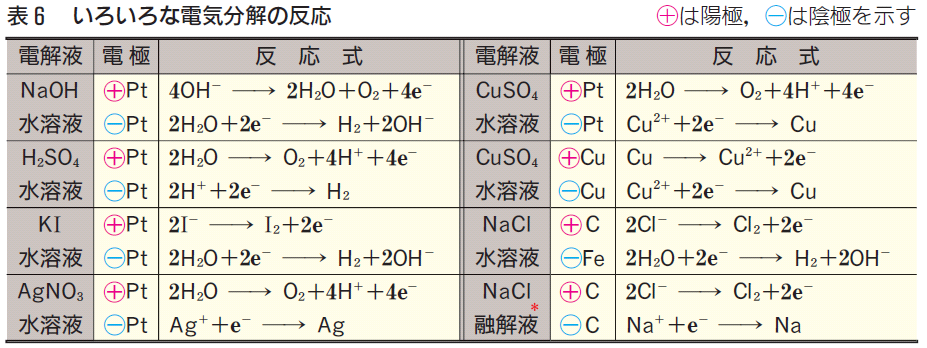
<陰極>
①イオン化傾向の小さな金属Cu2+、Ag+などは、電子を受け取り単体の金属として析出。
ここで、「水溶液中なら金属析出はCu、Agだけ」としてOK!
Cu2+ + 2e- → Cu
Ag+ + e- → Ag
②イオン化傾向の大きな金属Na+などは、電子を受け取らず、代わりにH2Oが電子を受け取りH2発生。
ここで、「水溶液中で、Cu2+、Ag+以外の金属イオンならH2発生」としてOK!
2H2O + 2e- → 2OH- + H2↑
③酸の水溶液は、H+が電子を受け取ってH2発生。
2H+ + 2e- → H2↑
※ここで、②③を良く見ると2モルのe-で1モルのH2が発生していますね?
つまり、センター試験なら③の反応式だけ覚えておけばいいんです! (③の反応式で考える時は、H2Oの電離によるH+を使ったんだからOH-が残っていく、pHが大きくなっていく、のも忘れないで!)
つまり、まとめるとこうですね!
◆ Cu2+、Ag+ならCu、Ag析出。それ以外はH2発生 ◆
<陽極>
①ハロゲンのイオンCl-、Br-、I- は電子放出して単体生成。
2Cl- → Cl2↑ + 2e-
②OH- は電子放出してO2発生。
4OH- → 2H2O + O2↑ + 4e-
③NO3-、SO42-は、電子放出せず、代わりにH2Oが電子を放出してO2発生。
2H2O → 4H+ + 4e- + O2↑
※ここで、②③を良く見ると4モルのe-で1モルのO2が発生していますね?
センター試験なら③の反応式だけ覚えておきましょう!(この時②③どちらもpHが小さくなっていきますね?)
では、まとめましょう!
◆ ハロゲンイオンならハロゲン単体生成。それ以外はO2発生 ◆
<融解塩電解の陰極>
①上の水溶液中では電子を受け取らなかった金属イオンが電子を受け取ります!
他に電子を受け取るものがいないんです!「さあ、電子受け取れ!」って感じですね。
Na+ + e- → Na
Al3+ + 3e- → Al
ついでに、これらの金属が熱い液体で生じてくる!様子を想像しておくといいですね。
<融解塩電解の陽極>
①Al2O3の融解塩電解では酸化物イオンO2-が存在し、これが電子を放出してO2発生。
2O2-→ O2↑ + 4e-
この式はアルミニウムの電解製錬の問題で考えるんですが、
この時の陽極は黒鉛Cを用いますので、発生したO2はCと化合します。
結局、CO2 または CO が発生します。
C + O2- → CO↑ + 2e-
C + 2O2- → CO2↑ + 4e-
<陽極が溶けるケース>
①陽極がCu、Agの場合は、電極自身が電子を放出し、溶けてしまいます!
Cu → Cu2+ + 2e-
※イオン化傾向の小さいCu、Agが溶けるんですから、これ以外の金属でも溶けるはずですね? でも、Pt電極は溶けませんね。また、これ以外の金属電極は出題されません。
あれ? イオン交換膜法の電極はFeだったんじゃない? 大丈夫! ここでFeは陰極として使われています。陽極は炭素電極です。
<大まとめ>
①発生する気体は H2、Cl2、O2 だけ。
②析出する金属は、Cu、Ag だけ。
③融解塩電解の時だけ、析出する金属は、Na、Al 。
④アルミニウムの電解製錬の陽極は、CO2 または CO 発生。
⑤ I2、Br2 析出の時は Cl2 に準じて考えれば良い。
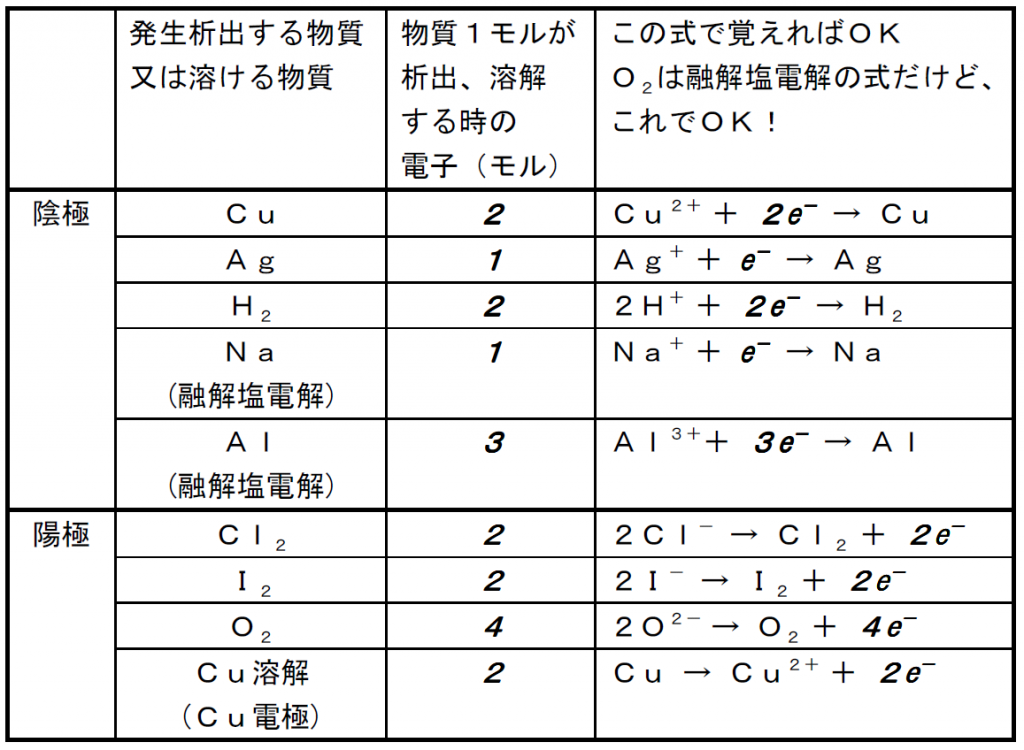
<最後に量関係です>
化学1
下図は、CuCl2水溶液の電気分解です。
電池が外に取り付けてあり、「電池の(-)から電子が流れ出てくる」ところに注意して下さい!
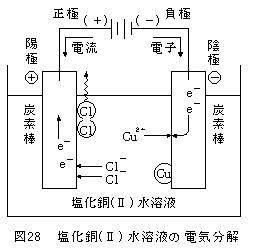
①電池の(-)から出てきた e- は、電気分解層の陰極(-)に入り、
この e- は水溶液中の Cu2+ に渡されます。
Cu2+ は e- を受け取り、 Cu となり陰極板上に析出します。
Cu2+ + 2e- → Cu
②電気分解層の陽極(+)から電池の方に e- が流れていきます。
では、陽極の e- はどこから供給されるのでしょう?
溶液中の Cl- ですね。 Cl- が陽極に寄ってきます。
Cl- は e- を陽極に渡し、 Cl 、そして Cl2 となり気体として発生します。
2Cl- → (2Cl + 2e-) → Cl2↑ + 2e-
化学1
電池の基本は、「2つの異なる金属を電気を通す水溶液に浸す」です。
下図のダニエル電池を見ながら復習してみましょう。
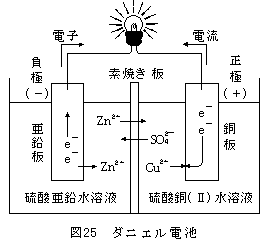
①イオン化傾向の大きい方の金属(Zn)が陽イオンになって水溶液(電解液)中に溶けだす。
Zn → Zn2+ + 2e-
金属は、陽イオンになるとき電子e-を置いていく。
このe-が導線にあふれ出てくる。
だから、この金属(Zn)の極板が負極(-)になります。
②負極からあふれ出たe-は、電球を通って正極に行きます。
e-は、溶液中の陽イオン(Cu2+)に渡され、Cuが正極上に析出します。
Cu2+ + 2e- → Cu
※一般的な電池ならここまで押さえておけばOKです!
ダニエル電池の場合、もうちょっと考えてみて下さい。
③負極側では、陽イオンが多い状態(Zn2+が増えた)
正極側では、陽イオンが少ない状態(Cu2+が減った)
ですね?
そこで、陽イオン又は陰イオンが素焼き板を通って移動します。
これで負極側の+と-のつり合い、正極側の+と-のつり合いがとれます。
つまり、Zn2+が負極側から正極側へ移動する。
また、SO42-が正極側から負極側へ移動する。
となります。(SO42-の移動だけで考えてもOKです)
化学1
金属のイオン化傾向、覚えやすいでしょう?
「貸そうかな、まあ、あてにすんな、ひど過ぎん借金 (にしといてね)」
この語呂合わせはわりとマシな感じしませんか?
「K、Ca、Na」は、「借りようかな」の方がいいかも。すると「借りようかな、まあ、あてにすんな、ひど過ぎん借金」となります。好きなほうで覚えて下さい。
さて、本題に入りましょう。
これを覚えたあと、それぞれの金属ごとの反応性を頭に入れる必要があるんですが、
「細かいところまでなかなか覚えきれない!」とか「この金属は塩酸に溶けたっけ?」とか、いつまでもすっきりしないことがあると思います。
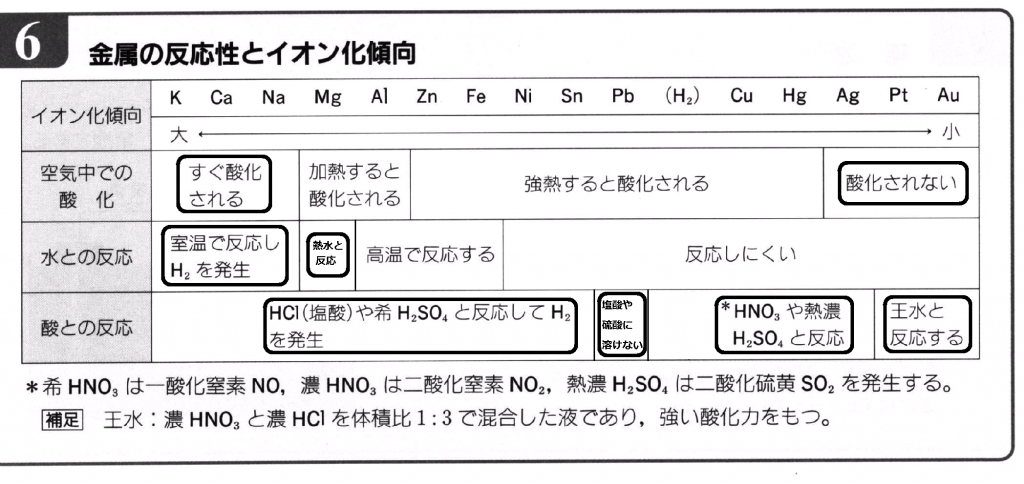
さて、入試でよく出題されている項目を念頭にまとめてみましょう。
ここだけは絶対に押さえて欲しいという個所を太枠で囲っておきました。
①K、Ca、Na は水と即反応、溶けてH2発生します。ですから、空気中でも即酸化されます。
②Ag、Pt、Au は空気中では酸化されません。錆びないし、加熱しても酸化されません。貴金属ですから!
③Mg は熱水と反応、溶けてH2発生します。(熱水じゃないと反応しないのはMgだけです)
④(H2)よりイオン化傾向が大きい金属つまり、「~まああてにすんな」までの金属は塩酸、希硫酸に溶けてH2発生です。
⑤ ④のうちのPbだけは、塩酸、希硫酸に溶けにくいんです。溶けないと覚えましょう。(この時生じるPbCl2、PbSO4が水に不溶性で反応が進まないためです)
⑥(H2)よりイオン化傾向が小さい金属つまり、「~ひどすぎん借金」までの金属は酸化力の強い酸でないと溶けません。(塩酸、希硫酸には酸化力ないから溶けないんです)
ア)Pt、Au は、酸化力最強の王水だけに溶けます。
イ)Cu、Hg、Ag は、硝酸、熱濃硫酸に溶けます。
※Cu(またはAg) + 希HNO3 → Cu2+(またはAg+) + NO↑
Cu(またはAg) + 濃HNO3 → Cu2+(またはAg+) + NO2↑
Cu(またはAg) + 濃H2SO4 → Cu2+(またはAg+) + SO2↑
(この3つの反応の完全な化学反応式は、2次試験受験の人は覚えて下さいね)
※王水は「1升3円」と覚えよう。濃硝酸と濃塩酸を、体積比で1:3の割合で混合して作ります。
化学1
下の表は、酸化還元反応の反応式(半反応式)です。
重要なのでテストに出すよ。覚えておいてね! なんて言われてきたんですが・・・
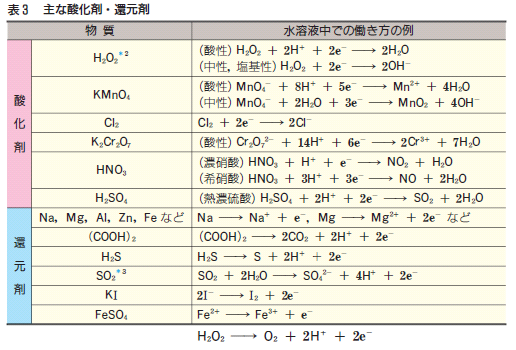
ただ、「覚えておいで!」と言われても、「え~! 何これ? 覚えられな~い!」となる気持ちは分かります。
では、上の式を、ぜひ覚えておきたいものに絞り込んでしまいましょう!
<酸化剤>
① H2O2(酸性溶液中)
② MnO4-(酸性溶液中)
<還元剤>
③ (COOH)2
④ I- ( KI )
⑤ H2O2
以上です!!
ハロゲン単体は陰イオンになりやすく、金属単体は陽イオンになりやすいので、これらの反応式はすぐに思い浮かぶと思います。(Cl2とNa、Mgなど)
また、濃HNO3、希HNO3、熱濃H2SO4、H2Sは別の考え方で式を作ることが出来ます。
Feのイオンは、 Fe2+ と Fe3+ (黄かっ色)がありますが、鉄Feがさびると黄かっ色になることから分かるように、最終的には Fe3+ に変化しやすいと覚えてしまいましょう!
もう一つ、④ I- ですが、ハロゲン(Cl2等)は陰イオンになりやすく酸化剤になるのが普通ですね。でも I はハロゲンの中では陰イオンになりにくく、単体に戻る 2I- → I2 + 2e- が起きやすいと覚えておきましょう。
さて、①②には共通点があります。
O2 + 2H+ + 2e- → H2O
O4 + 8H+ + 5e- → 4H2O
の部分です。 O と H で H2O になるということと、この反応式の部分でe-を受け取っているので酸化剤として働いているのが分かります。
また、③④にも共通点があります。
H2 の部分が、 → 2H+ + 2e- となっています。
この部分で e- を与えているので還元剤として働いているのが分かりますね。
どうですか? こんな感じで覚えられそうですね!
あとちょっと気になるのは、 Cr2O72- 、 Sn2+ なんですが、これは第3部無機のところで触れましょう。
化学1
まず、「還元剤は、相手に電子e-を与える」、「酸化剤は、相手から電子e-を受け取る」、を押さえて下さい。
では、過酸化水素水溶液と硫酸酸性過マンガン酸カリウム水溶液とを混合した時の酸化還元反応式の作り方を順を追って丁寧に説明していきます。
① H2O2 → 2H+ + 2e- + O2
この式は、右辺に電子e-があります。この e- は相手に与える e- なんです。
ここ大丈夫ですか?
また、この反応は、相手に e- を与えるので、 H2O2 の還元剤としての反応式と言えます。
(これだけつまり H2O2 だけでは起こらないので、半反応式なんて言います)
② MnO4- + 8H+ + 5e- → Mn2+ + 4H2O
この式は、左辺に電子e-があります。この e- は相手から受け取る e- です。
これも理解しておいてくださいね。
この反応は、相手から e- を受け取るので、 MnO4- の酸化剤としての反応式と言えます。
(これも MnO4- の酸化剤としての半反応式と呼ばれます)
もう一つ、MnO4- は酸性溶液中で強い酸化作用を示します。よって硫酸等の酸を混ぜて使用します。ですから、この反応式の左辺に酸性の元 H+ が加えられているんです。
③ ①式で出される e- を、②式ですべて受け取るように e- の係数を揃えます。
5H2O2 → 10H+ + 10e- + 5O2
2MnO4- + 16H+ + 10e- → 2Mn2+ + 8H2O
④ さて、H2O2 、MnO4- 、 H+ を混合してみましょう。上の2式を、左辺、右辺どうし加えてみて下さい。
5H2O2 + 6H+ + 2MnO4- → 2Mn2+ + 8H2O + 5O2
これでほぼ完成なのですが、上の反応式の左辺中の H+ 、 MnO4- 、はそれだけで単独で存在する物質ではないので、存在する物質を使って書き直します。
⑤ 6H+ は 3H2SO4 、 2MnO4- は 2KMnO4 、と書き直しましょう。
5H2O2 + 3H2SO4 + 2KMnO4 → 2Mn2+ + 8H2O + 5O2
⑥ あれ? 左辺にある SO42- 、 K+ はどこに消えたのかな? 消えてしまってはおかしいですから右辺にも登場させましょう。
5H2O2+3H2SO4+2KMnO4→2Mn2++8H2O+5O2+3SO42-+2K+
⑦ 最後に、右辺の 2Mn2+ と 2SO42- 、を結合させて 2MnSO4 、
2K+ と SO42- を結合させて K2SO4 、と書き直しましょう。
5H2O2 + 3H2SO4 + 2KMnO4 → 2MnSO4 + K2SO4 + 8H2O + 5O2
お疲れ様でした! 過酸化水素水溶液と硫酸酸性過マンガン酸カリウム水溶液を混合した時の酸化還元反応式が出来ました!
各自1つ1つ確認しながら、ぜひ紙に書きながら最後まで進めていってみて下さい。
この反応は、入試にも頻出するものです。
化学1
酸化剤と還元剤について
※「酸化する」と「酸化される」では対象が異なります。
ちょっとややこしいのですが「酸化する」と書くと、酸化されるのは「自身」ではなく「相手」になります。
①まず、▲▲剤という物質は、相手を▲▲する物質です。
②ですから、「酸化剤」は「相手を酸化」して、「自身は還元」されます。
電子e-のやり取りで酸化還元を考えてみると、電子e-を受け取るのが酸化剤ということになります。
①電子e-を受け取ると陰イオンになりますから、陰イオンになりやすい元素は電子e-を受け取りやすい、つまり酸化力が強い、酸化剤として強い、となります。
②周期表右上の元素ほど陰イオンになりやすかったですね。
ですから、「周期表右上の元素ほど酸化力が強い」と覚えましょう! この時、18族希ガス元素は除いて考えて下さい。 すると酸化力最強の元素はフッ素F、となりますね。
③ハロゲン単体の酸化力の比較がよく問われます。
17族単体を周期表上から順に記すと、F2、Cl2、Br2、I2、ですね。「周期表右上の元素ほど酸化力が強い」ということは、「周期表の上の元素ほど酸化力が強い」と言えますから、17族の中での酸化力の強さは、F2>Cl2>Br2>I2、となる訳です。
化学1
反応後に物質が「酸化された」か「還元された」かを判定するのに「酸化数」が考えられました。(前回も言いました)
①「電子e-が減る」=「酸化された」ですね。
「-が減る」=「酸化数が増える」ということで
「酸化数が増えた」=「酸化された」 と判定します。逆に
「酸化数が減った」=「還元された」となります。
②ここで、教科書の表にあった定義は「暗記する」んですよ!
また素早く答えが出るように、くり返し、書いたり声に出したり友達と言い合ったりして覚えてね!
「化合物中のClは?」 「-1だよっ!!」 てな感じでね。
H2O2のOが、0とか-2とか-4とかいった答は、定義をまだしっかり覚えきってない状態です。
覚えたら、出来るだけたくさん練習問題やった方がいいです。
教科書やニューステップアップにある練習問題やっておこう!
練習は日にちをあけて再度やった方が絶対にいいです! 定着します!