電気分解の陰極、陽極で生じる物質は何か? と聞かれた時に、場合分けをして考えなければいけません。
OH
-なら分解して、SO
42-なら分解せず代わりにH
2Oが分解する・・・
量関係の問題も良く出されるので反応式も重要ですね。
「はぁ、これ覚えるのかぁ・・・」と思いませんでしたか?
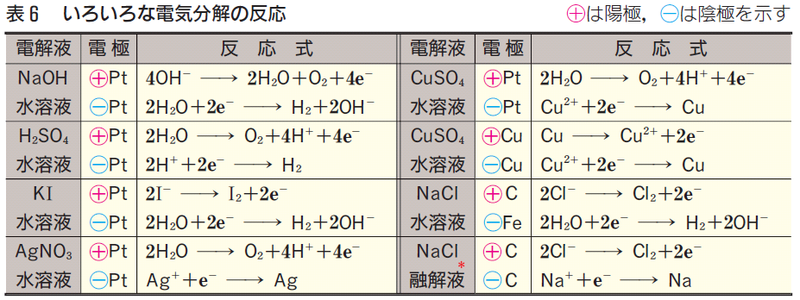
それでは、入試に出るものに限って、思い切ってまとめてみましょう!!
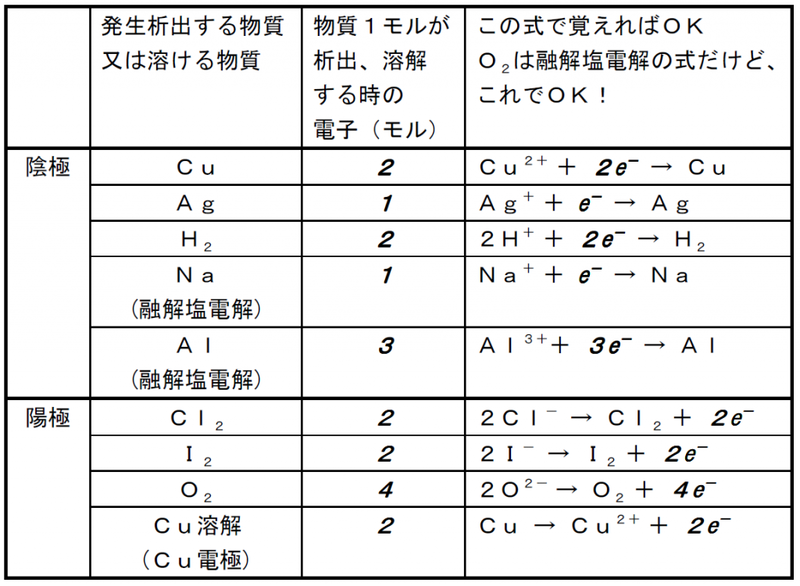
<陰極>
①イオン化傾向の小さな金属Cu
2+、Ag
+などは、電子を受け取り単体の金属として析出。
ここで、「水溶液中なら金属析出はCu、Agだけ」としてOK!
Cu
2+ + 2e
- → Cu
Ag
+ + e- → Ag ②イオン化傾向の大きな金属Na
+などは、電子を受け取らず、代わりにH
2Oが電子を受け取りH
2発生。
ここで、「水溶液中で、Cu
2+、Ag
+以外の金属イオンならH
2発生」としてOK!
2H
2O + 2e
- → 2OH
- + H
2↑
③酸の水溶液は、H
+が電子を受け取ってH
2発生。
2H
+ + 2e
- → H
2↑
※ここで、②③を良く見ると2モルのe
-で1モルのH
2が発生していますね?
つまり、センター試験なら③の反応式だけ覚えておけばいいんです! (③の反応式で考える時は、H
2Oの電離によるH
+を使ったんだからOH
-が残っていく、pHが大きくなっていく、のも忘れないで!)
つまり、まとめるとこうですね!
◆ Cu
2+、Ag
+ならCu、Ag析出。それ以外はH
2発生 ◆
<陽極>
①ハロゲンのイオンCl
-、Br
-、I
- は電子放出して単体生成。
2Cl
- → Cl
2↑ + 2e
- ②OH
- は電子放出してO
2発生。
4OH
- → 2H
2O + O
2↑ + 4e
- ③NO
3-、SO
42-は、電子放出せず、代わりにH
2Oが電子を放出してO
2発生。
2H
2O → 4H
+ + 4e
- + O
2↑
※ここで、②③を良く見ると4モルのe
-で1モルのO
2が発生していますね?
センター試験なら③の反応式だけ覚えておきましょう!(この時②③どちらもpHが小さくなっていきますね?)
では、まとめましょう!
◆ ハロゲンイオンならハロゲン単体生成。それ以外はO
2発生 ◆
<融解塩電解の陰極>
①上の水溶液中では電子を受け取らなかった金属イオンが電子を受け取ります!
他に電子を受け取るものがいないんです!「さあ、電子受け取れ!」って感じですね。
Na
+ + e
- → Na
Al
3+ + 3e
- → Al
ついでに、これらの金属が熱い液体で生じてくる!様子を想像しておくといいですね。
<融解塩電解の陽極>
①Al
2O
3の融解塩電解では酸化物イオンO
2-が存在し、これが電子を放出してO
2発生。
2O
2-→ O
2↑ + 4e
- この式はアルミニウムの電解製錬の問題で考えるんですが、
この時の陽極は黒鉛Cを用いますので、発生したO
2はCと化合します。
結局、CO
2 または CO が発生します。
C + O
2- → CO↑ + 2e
- C + 2O
2- → CO
2↑ + 4e
-
<陽極が溶けるケース>
①陽極がCu、Agの場合は、電極自身が電子を放出し、溶けてしまいます!
Cu → Cu
2+ + 2e
-
※イオン化傾向の小さいCu、Agが溶けるんですから、これ以外の金属でも溶けるはずですね? でも、Pt電極は溶けませんね。また、これ以外の金属電極は出題されません。
あれ? イオン交換膜法の電極はFeだったんじゃない? 大丈夫! ここでFeは陰極として使われています。陽極は炭素電極です。
<大まとめ>
①発生する気体は H
2、Cl
2、O
2 だけ。
②析出する金属は、Cu、Ag だけ。
③融解塩電解の時だけ、析出する金属は、Na、Al 。
④アルミニウムの電解製錬の陽極は、CO
2 または CO 発生。
⑤ I
2、Br
2 析出の時は Cl
2 に準じて考えれば良い。
<最後に量関係です>