電池の基本は、「2つの異なる金属を電気を通す水溶液に浸す」です。
下図のダニエル電池を見ながら復習してみましょう。
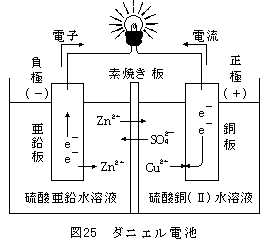
①イオン化傾向の大きい方の金属(Zn)が陽イオンになって水溶液(電解液)中に溶けだす。
Zn → Zn
2+ + 2e
- 金属は、陽イオンになるとき電子e
-を置いていく。
このe
-が導線にあふれ出てくる。
だから、この金属(Zn)の極板が負極(-)になります。
②負極からあふれ出たe
-は、電球を通って正極に行きます。
e
-は、溶液中の陽イオン(Cu
2+)に渡され、Cuが正極上に析出します。
Cu
2+ + 2e
- → Cu
※一般的な電池ならここまで押さえておけばOKです!
ダニエル電池の場合、もうちょっと考えてみて下さい。
③負極側では、陽イオンが多い状態(Zn
2+が増えた)
正極側では、陽イオンが少ない状態(Cu
2+が減った)
ですね?
そこで、陽イオン又は陰イオンが素焼き板を通って移動します。
これで負極側の+と-のつり合い、正極側の+と-のつり合いがとれます。
つまり、Zn
2+が負極側から正極側へ移動する。
また、SO
42-が正極側から負極側へ移動する。
となります。(SO
42-の移動だけで考えてもOKです)


