下の表は、酸化還元反応の反応式(半反応式)です。
重要なのでテストに出すよ。覚えておいてね! なんて言われてきたんですが・・・
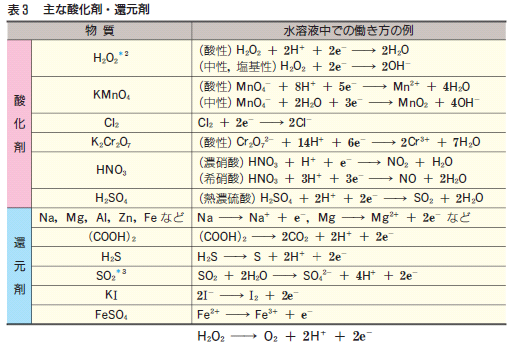
ただ、「覚えておいで!」と言われても、「え~! 何これ? 覚えられな~い!」となる気持ちは分かります。
では、上の式を、ぜひ覚えておきたいものに絞り込んでしまいましょう!
<酸化剤>
① H
2O
2(酸性溶液中)
② MnO
4-(酸性溶液中)
<還元剤>
③ (COOH)
2 ④ I
- ( KI )
⑤ H
2O
2以上です!!
ハロゲン単体は陰イオンになりやすく、金属単体は陽イオンになりやすいので、これらの反応式はすぐに思い浮かぶと思います。(Cl
2とNa、Mgなど)
また、濃HNO
3、希HNO
3、熱濃H
2SO
4、H
2Sは別の考え方で式を作ることが出来ます。
Feのイオンは、 Fe
2+ と Fe
3+ (黄かっ色)がありますが、鉄Feがさびると黄かっ色になることから分かるように、最終的には Fe
3+ に変化しやすいと覚えてしまいましょう!
もう一つ、④ I
- ですが、ハロゲン(Cl
2等)は陰イオンになりやすく酸化剤になるのが普通ですね。でも I はハロゲンの中では陰イオンになりにくく、単体に戻る 2I
- → I
2 + 2e
- が起きやすいと覚えておきましょう。
さて、①②には共通点があります。
O
2 + 2H
+ + 2e
- → H
2O
O
4 + 8H
+ + 5e
- → 4H
2O
の部分です。 O と H で H
2O になるということと、この反応式の部分でe
-を受け取っているので酸化剤として働いているのが分かります。
また、③④にも共通点があります。
H
2 の部分が、 → 2H
+ + 2e
- となっています。
この部分で e
- を与えているので還元剤として働いているのが分かりますね。
どうですか? こんな感じで覚えられそうですね!
あとちょっと気になるのは、 Cr
2O
72- 、 Sn
2+ なんですが、これは第3部無機のところで触れましょう。


