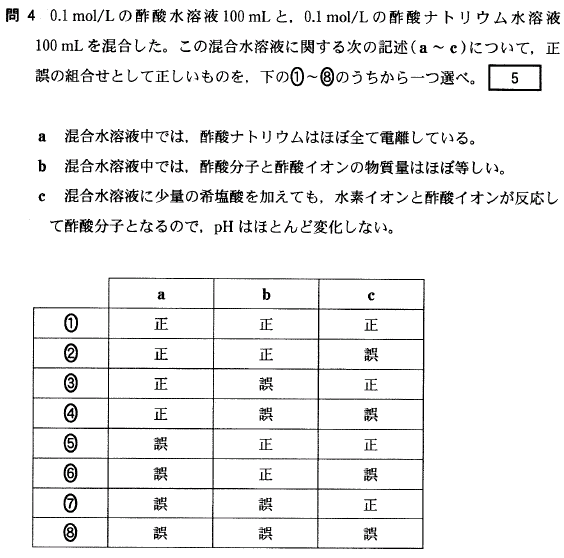
[5]正解①
弱酸と弱酸の塩の混合溶液は、緩衝液となります。
また、溶液中に酢酸CH
3COOH、酢酸ナトリウムCH
3COONa、どちらも、0.1(mol/L)× 0.1(L)= 0.01(mol)存在しています。
a.(正) 酢酸ナトリウムCH
3COONaは水溶性のイオン結合性物質なので、水中でほぼすべて電離しています。
b.(正) 酢酸は弱酸でほとんど電離しないので、CH
3COOHは0.01(mol)存在しています。また、上記a.の通りCH
3COONaはほぼ完全電離で、CH
3COONa → CH
3COO
- + Na
+ ですから、CH
3COO
- も 0.01(mol)存在すると考えます。
c.(正) この混合溶液中には、CH
3COOH、CH
3COO
- 、Na
+ が大量に存在しています。この溶液中に H
+ を加えると、CH
3COO
- + H
+ → CH
3COOH の反応により H
+ が消費されるため、H
+ はほとんど増加せず、pHもほとんど変化しない、と考えます。


