[1]正解④
非金属の単体、もしくは非金属同士の化合物が分子結晶を作りますが、例外は共有結合の結晶のダイヤモンド、二酸化ケイ素、それに黒鉛、ケイ素も忘れないようにしましょう。また、塩化アンモニウムのようなアンモニウム塩はイオン結晶になりますので注意して下さい。
①②は共有結合の結晶、③はイオン結晶(複塩)、⑤は金属結晶です。
[2]正解③
以下の電子式を描けば、すぐに分かります。
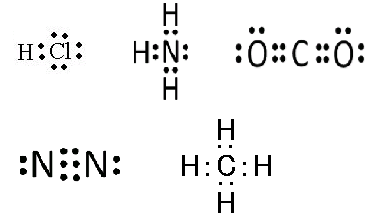
① 3組(Clに3組) 、 ② 1組(Nに1組) 、 ③ 4組(Oに2組×2)
④ 2組(Nに1組×2) 、 ⑤ なし
[3]正解②
面心立方格子では、各面の対角線上に球が接して並びます。よって、下図のように、各面の対角線の長さは、原子半径 r の4つ分(4r)になります。
上図では、金属原子が接しているように描かれていませんが、各面では、原子が下図のように接して並んでいます。
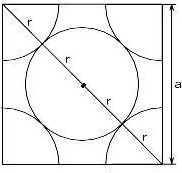
単位格子の一辺の長さ a と対角線の関係を比で表すと、
a : 4r = 1 : √2
よって、
a = 2√2r となります。
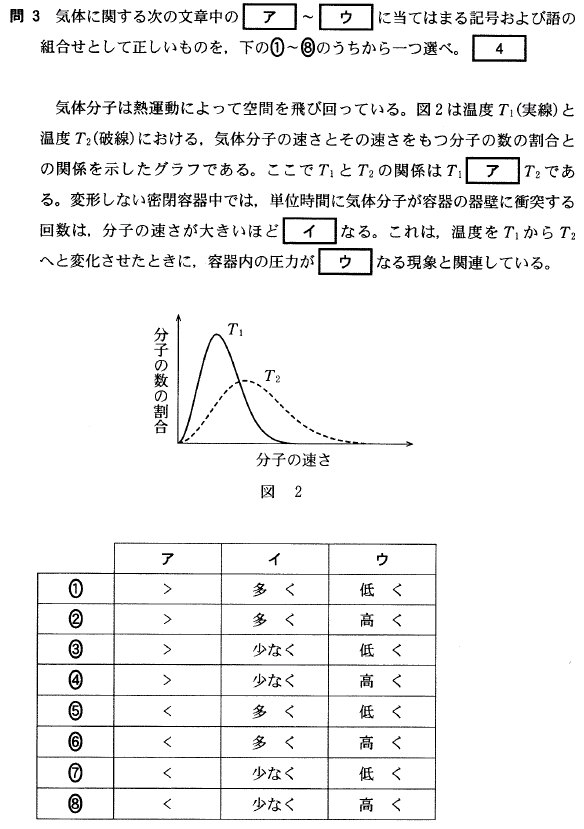
[4]正解⑥
気体中の分子の平均の速さが大きいほど、温度が高い、と考えられますね。
図2では、グラフのピークがある所の速さが大きい方が、温度が高い、と言えます。(ピークの高低の比較ではない)
また、分子の速さが大きいほど、容器の壁に衝突する回数は増えるので、圧力も大きくなります。
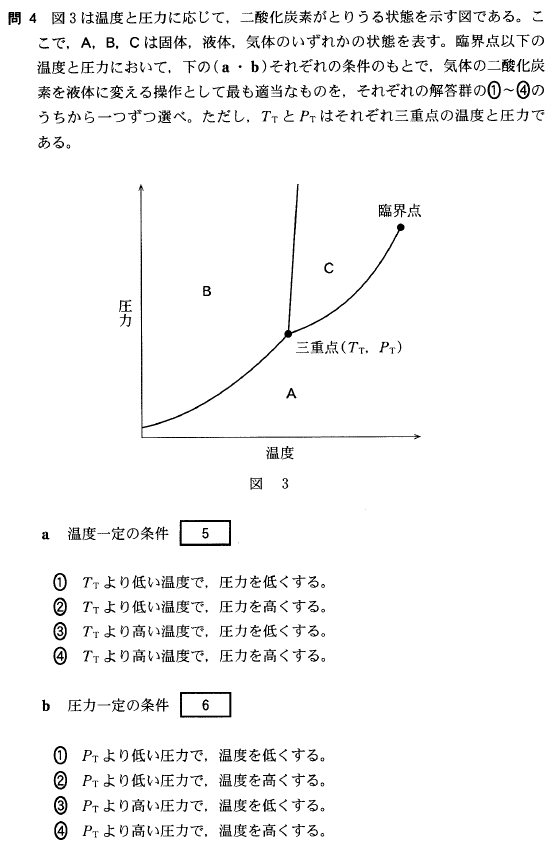
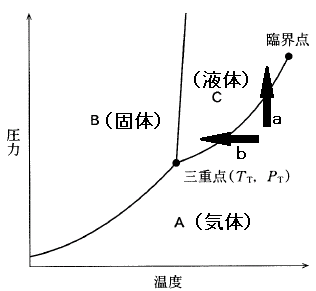
状態図を考える時、迷ったら、温度を下げていった時、水は、水蒸気(気体)→水(液体)→氷(固体)と変化することを思い出して下さい。そして状態図にあてはめてみます。すると、
A領域が気体、C領域が液体、B領域が固体を表していることが分かります。
さて、この問題では、気体 → 液体 と変化させたいのですから、A領域からC領域に変化させたい、ということです。
では、下図の矢印 a、b を見て下さい。
この矢印のように温度、圧力を変化させると、気体から液体に変わることになりますね。
[5]正解④
TTより高い温度でないと、C領域には行けません。そして、TTより高い温度で圧力を上げると、A領域からC領域に行けることが分かります。
[6]正解③
PTより高い圧力でないと、C領域には行けません。そして、PTより高い圧力で温度を下げると、A領域からC領域に行けることが分かります。

[7]正解⑥
水蒸気と窒素の混合気体を圧縮すると、水蒸気は、(飽和)水蒸気圧を保ったまま一部凝縮します。窒素は、体積に反比例した圧力となります。
さて、最初の窒素の分圧は、
4.50 × 104 - 3.60 × 103 = 4.50 × 104 - 0.36 × 104 = 4.14 × 104(Pa) です。
容積を半分にした時の窒素の分圧は、
4.14 × 104 × 2 = 8.28 × 104(Pa)
これに水蒸気圧が加わったものが全圧ですから、
8.28 × 104 + 3.60 × 103 = 8.28 × 104 + 0.36 × 104 = 8.64 × 104(Pa) となります。
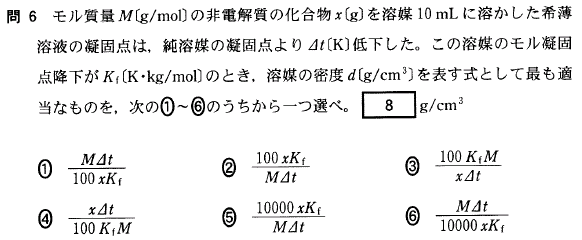
[8]正解②
凝固点降下度 Δt は、溶液の質量モル濃度に比例します。
まず、この溶質x(g)は、x/M (mol)ですね。
一方、10(mL)で密度dの溶媒の質量は、10d(g)ですから、この溶液の質量モル濃度は、
x/M × 1000/10d = 100x/Md (mol/kg)となります。
これらを凝固点降下の式に代入すると、
Δt=Kf × 100x/Md
よって、
d = 100xKf/MΔt となります。

[1]正解④
H2、N2の結合を切るのにエネルギーが必要で、H原子、N原子が結合してNH3分子が出来る時にエネルギーを放出します。これらのエネルギーの差し引きが+46(kJ)ということです。
また、NH3分中のN-H結合(3か所)をすべて切断するためのエネルギーをQ(kJ)とすると
NH3 + Q(kJ) = N + 3H と表され、この式の左辺右辺を入れ替えると
N + 3H = NH3 + Q(kJ) となりますね。
では、以下の式3つすべてを辺々足してみましょう。
3/2 H2 = 3H - 3/2 × 436(kJ)
1/2 N2 = N - 1/2 × 945(kJ)
N + 3H = NH3 + Q(kJ)
結果は、
3/2 H2 + 1/2 N2 = NH3 -1126.5(kJ)+ Q(kJ)
-1126.5(kJ)+ Q(kJ) = 46(kJ) ですから、これを解いて、
Q = 1172.5(kJ) となり、
最も近い値は④ですね。

[2]正解③
温度一定で圧縮する(圧力を上げる)と、圧力を下げる方向つまりN2O4が増える方向に、
平衡が移動します。
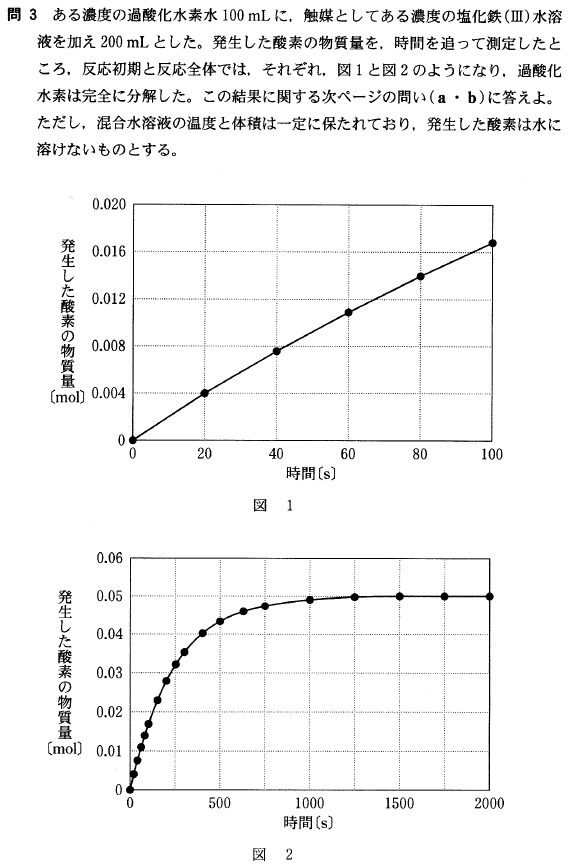

[3]正解⑤
発生した全酸素O2は 0.05(mol)、
またこの時の反応式は、2H2O2 → 2H2O + O2 ↑ ですから、
H2O2 は、0.05(mol)× 2 = 0.1(mol)あったことになります。
最初の溶液の体積は、100(mL)つまり 0.1(L)ですから、モル濃度は、
0.1(mol)/0.1(L)= 1(mol/L)
[4]正解③
最初の20秒間で発生したO2は 0.004(mol)ですから、分解した H2O2 は 0.008(mol)です。
この時の溶液の体積は、200(mL)つまり 0.2(L)ですから、
減少したモル濃度は、0.008(mol)/0.2(L)= 0.04(mol/L)となります。(溶液を加えているので体積が増えていることに注意)
これが20秒間に起こったので、H2O2 の分解速度は、
0.04(mol/L)/20(s)= 0.002(mol/L・s) = 2 × 10-3(mol/L・s) となります。