
a.
ホウ素は13族元素で価電子は3個です。
答[1]①
b.
各物質1g中のCの物質量で比較しましょう。
① CO (1/28) × 1 = 1/28
② C6H6 (1/78) × 6 = 1/13
③ C2H6 (1/30) × 2 = 1/15
④ C2H6O (1/46) × 2 = 1/23
⑤ CO2 (1/44) × 1 = 1/44
⑥ CH2Cl2 (1/85) × 1 = 1/85
答[2]⑥

問2
原子番号は陽子の数を表しているので、これに中性子の数を加えないと質量数にはなりません。
答[3]④
問3
取り出しすぎた試薬は、元の容器に戻してはいけません。
答[4]③

V(L)ではなく、1(L)の溶液で考えて良いのです!
1(L) → 1000(cm3)
この溶液の質量は、1000(cm3) × d(g/cm3) = 1000d(g) です。
この中の溶質の質量は、1000d × (10/100) =100d(g) です。
この溶質の物質量は、100d/M(mol) です。
∴ この溶液のモル濃度は、100d/M (mol/L)
答[5]②

酸素からオゾンが生じる時の化学反応式は、
3O2 → 2O3
この反応式から、
3molのO2 から2molのO3 が生じ、1mol分の気体が減少する、と考えましょう!!
よって、
反応O2 : 生成O3 : 気体減少分 = 3 : 2 : 1 です。
これらの比は「物質量の比」、また「体積の比」でもあります。
さて、ここで、気体の減少分は
150 - 144 = 6mL です。
減少分の3倍のO2 が反応したので、反応したO2 は、
6mL×3=18mL です。
よって、反応したO2 の割合は、
(18/150) × 100 = 12%
答[6]⑤

⑤では、墨汁が拡散して全体が黒くなった訳ですね。
拡散は化学反応ではありません。
答[7]⑤

やり方は色々と考えられます。
上の2式を加算すると、
CH4 + H2O(気) = CH3OH(液) + H2 + (Q1+Q2)kJ
この式に、反応熱=生成物の生成熱の和-反応物の反応熱の和を用いましょう。
Q1+Q2 = 239-(75+242)
∴ Q1+Q2 = -78kJ
答[1]②

a.
上の反応でH2O(気)が生じた時 Q1kJの熱が発生し、
その後、H2O(気)がH2O(液)になる時 蒸発熱を生じますから、
Q2はQ1より蒸発熱分だけ大きいと考えられます。
よって、アの答は、Q1<Q2
b.
トランス-2-ブテン、シス-2-ブテンが燃焼する時、
どちらもCO2、H2Oが同じ物質量ずつ生成し、
この生成物は安定で化学エネルギーは小さいと考えられます。
(トランス-2-ブテン、シス-2-ブテンのどちらよりも小さい)
また、トランス-2-ブテンよりシス-2-ブテンの方が不安定なので、
シス-2-ブテンの方がトランス型より化学エネルギーは大きいと考えられます。
(エネルギー図でシス-2-ブテンの方が上位に来る)
以上より、これら2物質が燃焼すると、
シス-2-ブテンの方が、トランス型より多くの燃焼熱を発生することになります。
よって、イの答は、Q3<Q4
答[2]①
エネルギー図を書いてみて下さい!
すごく分かりやすいですよ!
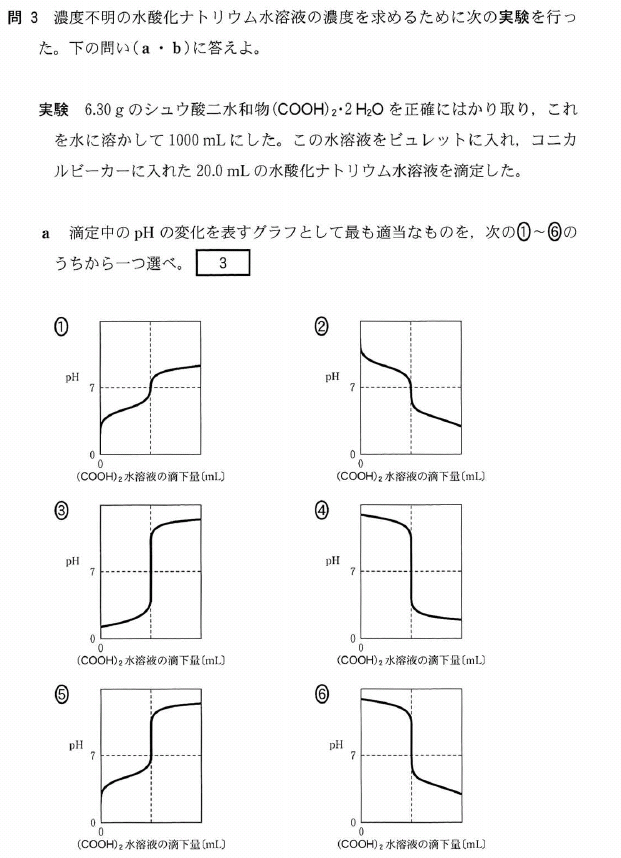
a.
強塩基を弱酸で滴定します。
⑤は、弱酸を強塩基で滴定する時の曲線です。間違えないように。
答[3]⑥
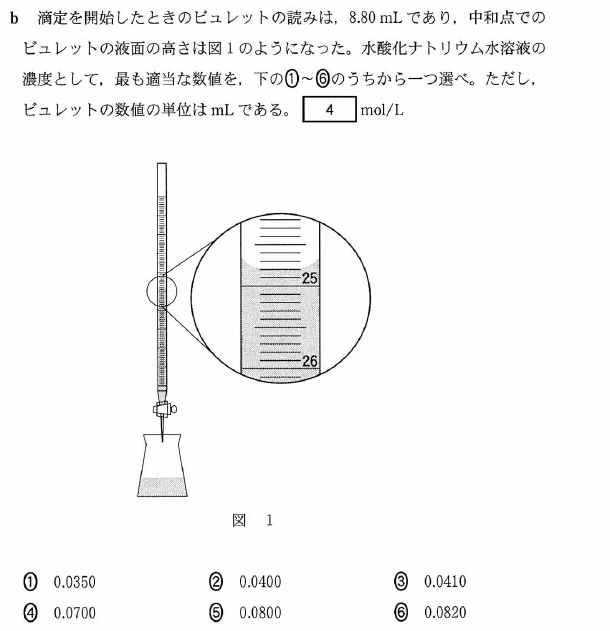
b.
図からビュレットの読みは、24.80mLです。
よって、NaOH溶液の滴下量は、24.8 - 8.8 = 16mLですね。
また、(COOH)2・2H2Oは、6.3/126=0.05mol
つまり、(COOH)2 も0.05mol
これを水に溶かして1Lにするので、
シュウ酸のモル濃度は0.05mol/L となります。
以上を中和滴定の公式に代入すると
2 × 0.05 × (16/1000) = 1 × c’ × (20/1000)
c’ = 0.08mol/L
答[4]⑤
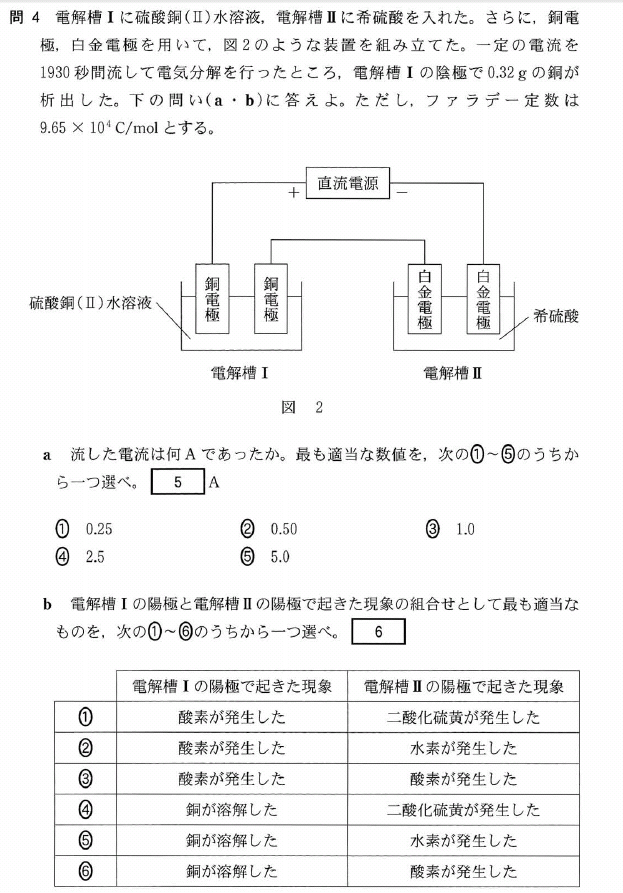
a.
Cuは、0.32/64 = 0.005mol 析出しています
また、Cu2+ + 2e- → Cu ですから、
流れた電子は、0.005 × 2 = 0.01mol です。
この電子は、電気量では、96500 × 0.01 = 965(C)になります。
Q = It より、 I = Q/t = 965/1930 = 0.5(A)
答[5]②
b.
電解層Ⅰの陽極では、Cu電極がイオン化して溶解し、
電解層Ⅱの陽極では、H2Oが酸化されて酸素が発生します。
答[6]⑥

酸化還元反応ですから、
還元剤である過酸化水素が与える e-(mol)と、
酸化剤である過マンガン酸カリウムの得る e-(mol)は等しいと考えます。
過酸化水素の濃度を c(mol/L)とすると、
c × (10/1000) × 2 = 0.05 × (20/1000) × 5
∴ c = 0.25(mol/L)
答[7]④