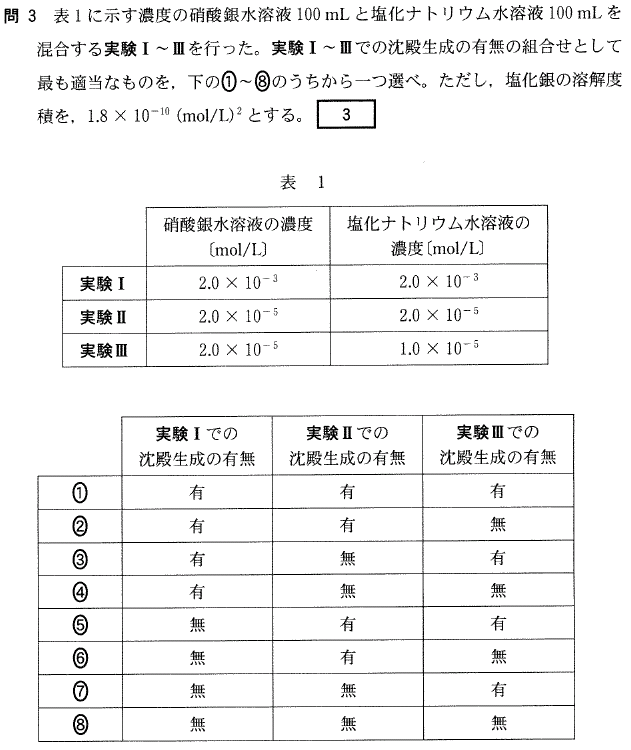
各実験での[Ag+] × [Cl-]の値を計算し、
これがAgClの溶解度積より大きいか小さいか調べます。
なお、2溶液の混合により体積が2倍になるので、
それぞれ[Ag+]、[Cl-]の濃度は1/2になることに注意しましょう。
実験Ⅰ [Ag+] = 2 × 10-3/2 = 1 × 10-3(mol/L)
[Cl-] = 2 × 10-3/2 = 1 × 10-3(mol/L)
∴ [Ag+] × [Cl-] = 1 × 10-3 × 1 × 10-3 = 1 × 10-6
これは溶解度積の1.8 × 10-10 より大きいので、沈殿が生じる。
実験Ⅱ [Ag+] = 2 × 10-5/2 = 1 × 10-5(mol/L)
[Cl-] = 2 × 10-5/2 = 1 × 10-5(mol/L)
∴ [Ag+] × [Cl-] = 1 × 10-5 × 1 × 10-5 = 1 × 10-10
これは溶解度積の1.8 × 10-10 より小さいので、沈殿は生じない。
実験Ⅲ [Ag+] = 2 × 10-5/2 = 1 × 10-5(mol/L)
[Cl-] = 1 × 10-5/2 = 5 × 10-6(mol/L)
∴ [Ag+] × [Cl-] = 1 × 10-5 × 5 × 10-6 = 5 × 10-11
これは溶解度積の1.8 × 10-10 より小さいので、沈殿は生じない。
答[3]④
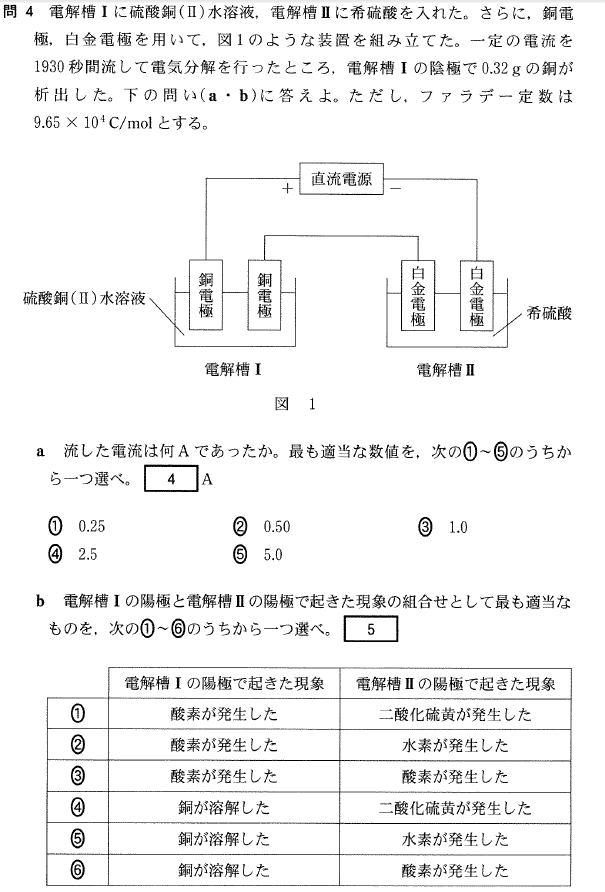
a. Cuは、0.32/64 = 0.005mol 析出しています
また、Cu2+ + 2e- → Cu ですから、
流れた電子は、0.005 × 2 = 0.01mol です。
この電子は、電気量では、96500×0.01=965(C)になります。
Q = It より、 I = Q/t = 965/1930 = 0.5(A)
答[4]②
b.電解層Ⅰの陽極では、Cu電極がイオン化して溶解し、
電解層Ⅱの陽極では、H2Oが酸化されて酸素が発生します。
答[5]⑥

酸化還元反応ですから、
還元剤である過酸化水素が与えるe-(mol)と、酸化剤である過マンガン酸カリウムの得るe-(mol)は等しい。
過酸化水素の濃度をc(mol/L)とすると、
c × (10/1000) × 2 = 0.05 × (20/1000) × 5
∴c=0.25(mol/L)
答[6]④

問1
一酸化炭素は水に溶けにくい気体です。
答[1]③
問2
二酸化硫黄と硫化水素の反応では、二酸化硫黄が酸化剤、硫化水素が還元剤としてはたらきます。
答[2]②

問3
青銅は銅とスズの合金です。
答[3]③
問4
Naの炭酸塩は水に良く溶けますが、Caの炭酸塩は水に溶けにくかったですね。
答[4]④

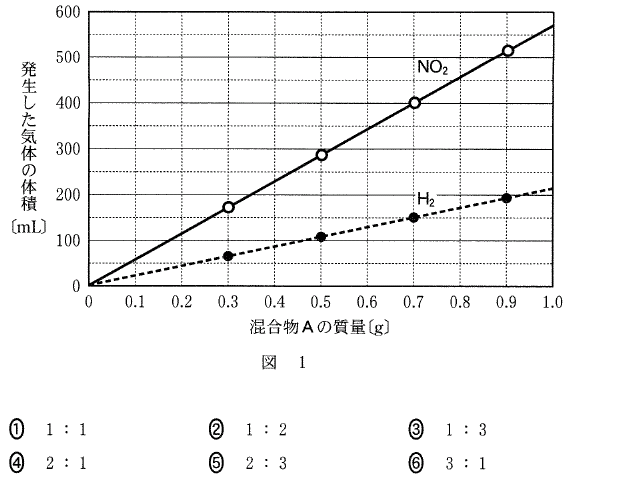
混合物0.7gでの発生気体の体積比に注目してみましょう。
NO2 : H2 = 400 : 150 = 8 : 3 です。
よって、NO2 : H2 = 8mol : 3mol も成り立ちます。
ここで、NO2 は8mol、H2 は3mol と限定して考えましょう。
反応式から、
8molのNO2 を生じるCuは4mol、
3molのH2 を生じるCuは2mol、と分かります。
Cu : Al = 4mol : 2mol = 2 : 1
答[5]④
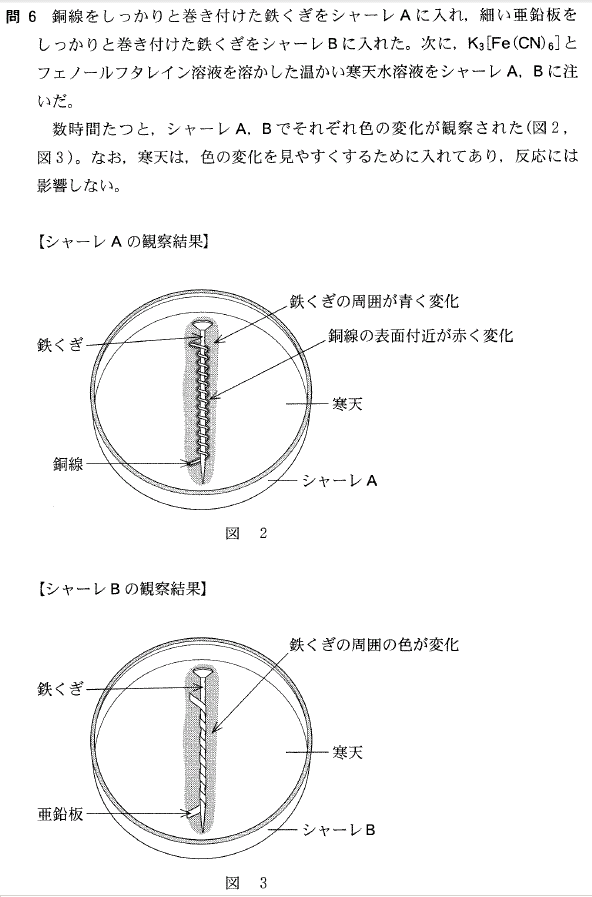

どう考えるのか、やや難しく感じたかもしれません。
どちらのシャーレ内も2種類の金属が、電解質溶液中で接しているので
電池が出来ているのです。
すると、イオン化傾向の大きな方の金属がイオンになって溶け、
イオン化傾向の小さな方の金属表面で電子が溶液中のイオン又は物質に渡されます。
a.イオン化傾向はFe>Cuですから、
Fe極が Fe → Fe2+ + 2e- となるため、
Fe2+ が K3[Fe(CN)6]と反応して青色となります。
(濃青色沈殿生成と教わったと思いますが、生成量が少ないのでこうなります)
Cu極側では、 2H2O + 2e- → 2OH- + H2 となり、
pHが大きくなるため、フェノールフタレインが赤色になります。
答[6]②
b.イオン化傾向はZn>Feですから、
Fe極側で、2H2O + 2e- → 2OH- + H2 となり、
pHが大きくなり、フェノールフタレインが赤色になります。
答[7]①

2-プロパノールを脱水して得られるアルケンはプロペン1種類のみ。
スチレンには幾何異性体は存在しません。
異性体は分子式が同じなので分子量は同じになります。
答[1][2]①、⑤
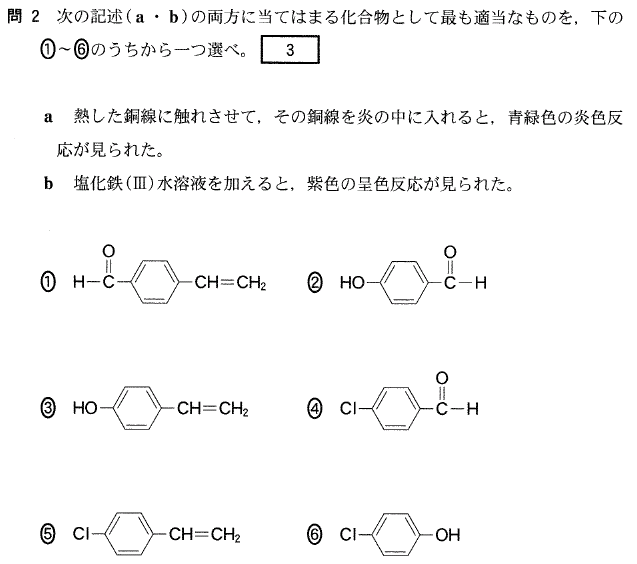
a.より、構成元素としてClが含まれていることが分かります。
b.からは、この化合物はフェノール類ということが分かります。
答[3]⑥

メタノールを酸化すると、ホルムアルデヒドが生成します。
エタノールを酸化すれば、アセトアルデヒドを生じます。
答[4]④