この問題を解説していて、ちょっとスムーズにいかない所がありました。
複雑な問題ではありませんが、出来るだけわかりやすく解説しないと、
細部にはまり込んで全体が見渡せなくなってしまいます。(いつでもそうですが)
このことを反省して、解説を記録しておこうと思います。

<解説>
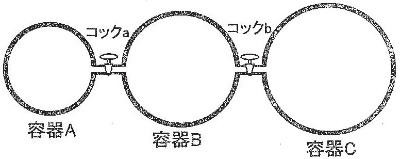
[ケ]
コックaを開くと、容器の体積は3倍(3V
1/V
1)になるので、
窒素の圧力は、1/3になる。
P
1 × 1/3 = P
1/3
[コ]
容器B中の窒素の物質量nは、
n = PV/RT
= (P
1/3)2V
1/RT
1
= 2P
1V
1/3RT
1[サ]
[ケ]と同様に、全コックを開いた後の水素の分圧を求めると、
P
1 × 3/6 = 3P
1/6
また、窒素の分圧は、[ケ]からさらに容器の体積が2倍(6V
1/3V
1)になるので、
P
1/3 × 1/2 = P
1/6
∴全圧は
3P
1/6 + P
1/6 = 4P
1/6 = 2P
1/3
[シ]
容器C(H
2)は容器A(N
2)に対して体積が3倍で、またどちらも同圧なので、
N
2とH
2の物質量は、反応前 m、3m とおける。また、反応分を x、3x とおくと、
N
2 + 3H
2 → 2NH
3
反応前 m 3m
反応分 -x -3x +2x
反応後 m-x 3m-3x 2x
反応後気体計(4m-2x)mol、NH
3 2xmol で、NH
3のモル分率1/3より
2x/(4m-2x) = 1/3
∴NH
3の物質量 2x = mモル
ここで、mは反応前のN
2の物質量と等しいから、
m=PV/RT
= P
1V
1/RT
1[ス]
反応後気体計 4m-2x = 4m-m = 3mモル
気体mモルに相当する圧力は、全コックを開けた時のN
2の分圧 P
1/6 と同じなので
反応後の全圧 = 3 × P
1/6 = P
1/2
[セ]
反応後の水素 3m-3x = 3m-3m/2 = 3m/2モル
[ス]と同様にして反応後の水素の分圧 = 3/2 × P
1/6 = P
1/4



