当サイトは、URLを変更しました。
新URL https://9monotaira.mydns.jp


当サイトは、URLを変更しました。
新URL https://9monotaira.mydns.jp



2013センター化学本試.pdf
第1問
「1」いつもの練習通り。
「2」いつも通り。<結合に使う>に注意。
「3」いつも通り。
「4」いつも通り。1つの式を立ててから計算した方が絶対に早い。
1400 × 49/100 × 1/98 = 7%
「5」いつも通り。molで比較しよう。
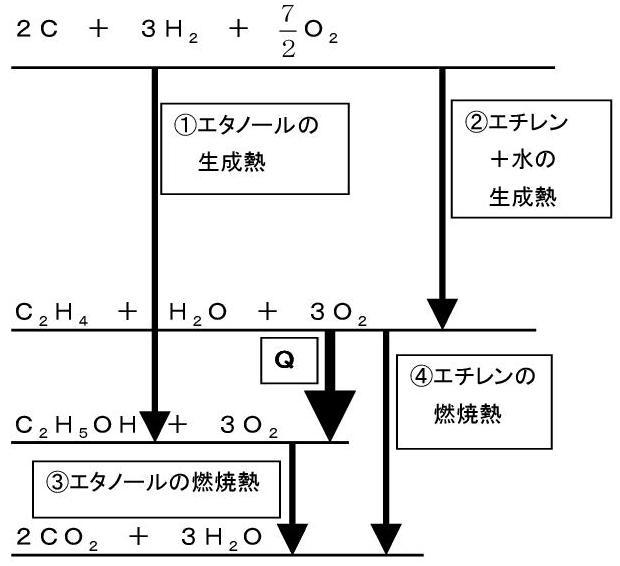
「6」これがいつもとちょっと違う。
M/MOx = 0.63
55/55+16X = 0.63
∴ X ≒2
Xを求めるタイプは初めてで、しかも答えが割り切れないので焦ったのでは。
「7」いつも通り。
ワインが酸化する=エタノールが酸化して酢酸になり酸っぱくなる。
| 日 | 月 | 火 | 水 | 木 | 金 | 土 |
28 | 29 | 30 | 1 | 2 | 3 | 4 |
5 | 6 | 7 | 8 | 9 | 10 | 11 |
12 | 13 | 14 | 15 | 16 | 17 | 18 |
19 | 20 | 21 | 22 | 23 | 24 | 25 |
26 | 27 | 28 | 29 | 30 | 31 | 1 |