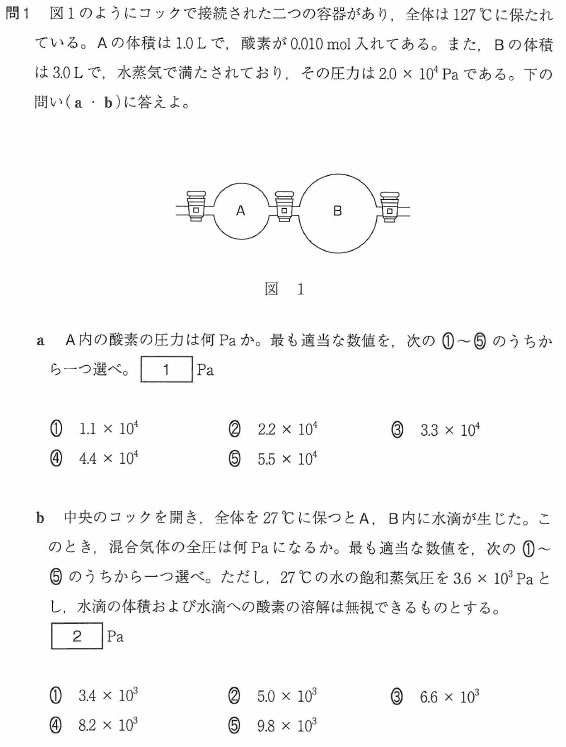
問1
a
コックはまだ開けられていません。容器Aの中だけで考えます。状態方程式を使います。
P=nRT/V
=(0.01×8.3×10
3×400/1.0)
≒3.3×10
4(Pa)
答[1]③
b
水滴が生じた状態なので、容器内は水蒸気で飽和している状態です。
ですから、この水蒸気の分圧は、飽和蒸気圧の3.6×10
3Paです。
一方、酸素の分圧は、
P=nRT/V
=(0.01×8.3×10
3×300/4.0)
≒6.2×10
3(Pa)
∴容器内全圧は、
3.6×10
3 + 6.2×10
3(Pa)=9.8×10
3(Pa)
答[2]⑤
さて、この問題では、水蒸気の分圧をどう考えるかがポイントです。
水滴が生じていれば、容器内は水蒸気が飽和している状態ですから、
この時の水蒸気圧は、その温度での飽和水蒸気圧(温度に応じた決まった値)になります。
蒸発できる量には限度があり、それ以上は蒸発できない訳です。
その時の水蒸気の圧力が飽和蒸気圧ということですね。
仮に水滴が生じていなければ、水蒸気が飽和していない状況ですから、
この時の水蒸気の分圧Pは、ボイルシャルルの法則で求めればいいのです。
計算してみましょうか?
2.0×10
4×3.0/400 = P×4.0/300 ですね。
P≒5.6×10
3Paとなりました。
この値は、飽和蒸気圧3.6×10
3Paを超えていますね。
飽和蒸気圧分を超えて蒸気にはなれないのですから
この時の水蒸気の圧力は3.6×10
3Paということになります。


