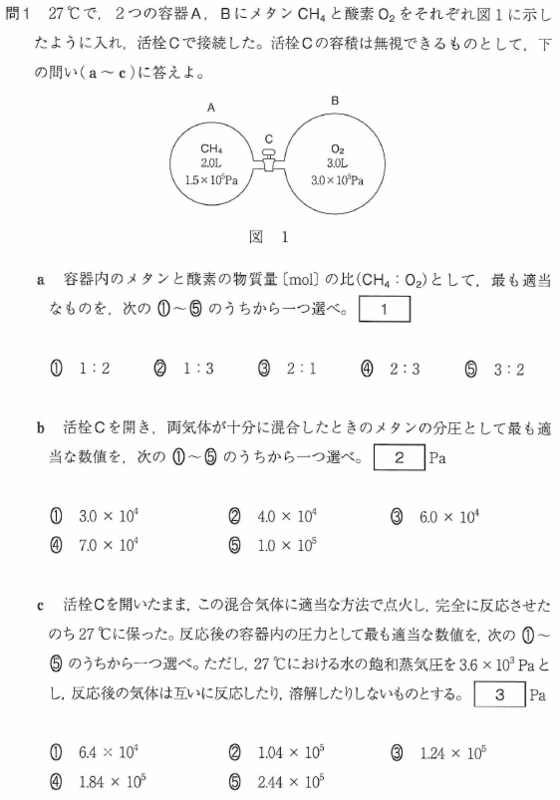
問1
a
状態方程式で各物質量を計算してもいいのですが、
CH
4とO
2を同一体積にした時の圧力で比較、又は
CH
4とO
2を同一圧力にした時の体積で比較、という手があります。計算早いです!
どちらも物質量の比が求められます。
では、CH
4とO
2を同一圧力3×10
5Paにした時の体積で考えてみましょう。
CH
4は1L、O
2は3Lですね。
ということは、CH
4(mol): O
2(mol)= 1 : 3 となります。いいでしょうか?
答[1]②
b
CH
4の体積は2Lから5Lになったので、圧力は2/5 倍になります。
1.5×10
5Pa × (2/5) = 6×10
4Pa
答[2]③
c
CH
4燃焼の反応式を書き、分圧(Pa)を記入してみましょう。
CH
4 + 2O
2 → CO
2 + 2H
2O
反応前 6×10
4 18×10
4
反応分 -6×10
4 -12×10
4 +6×10
4 +12×10
4
反応後
6×10
4 6×10
4 12×10
4
ここで、生じたH
2Oについて考えてみましょう。(重要ポイントです!)
12×10
4Paとなっていますね? これは飽和水蒸気圧 3.6×10
3Pa を超えています。
このことから水蒸気は飽和状態で、この時の水蒸気圧は3.6×10
3Paだ ということです。
よって反応後の全圧は、
6×10
4 + 6×10
4 + 0.36×10
4 = 12.36×10
4 ≒ 1.24×10
5Pa
答[3]③


