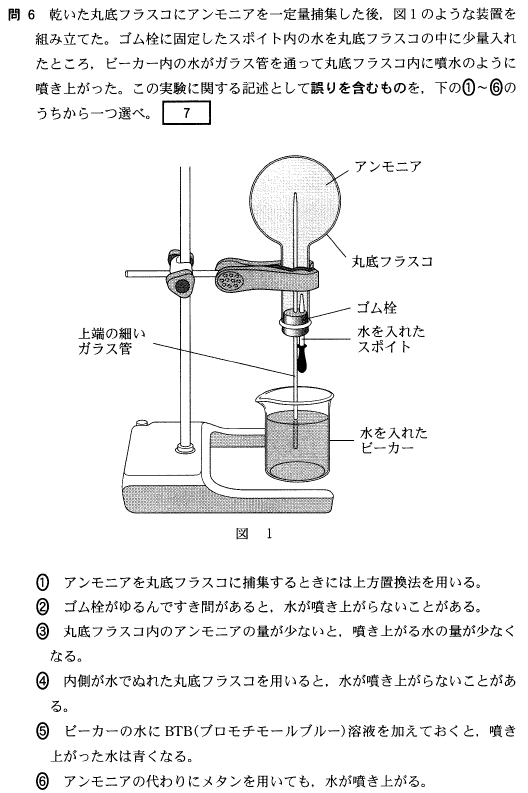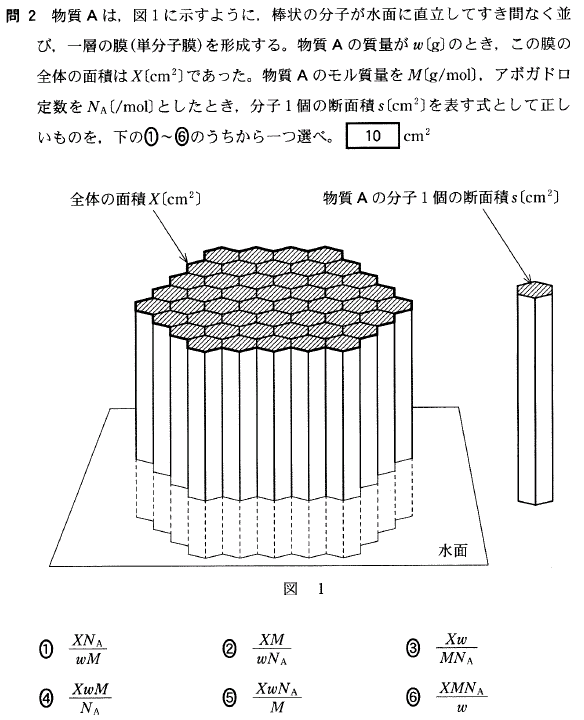
[14]正解⑤
ポイントが3つあります。
1つめは、指示薬の色が何色から何色に変わっていったかを見て下さい。
これより、AとBは塩基だと分かります。
ですから、これをHCl(強酸)で中和したことになります。
同様に、Cは酸だと分かり、これをNaOH(強塩基)で中和したことになります。
2つめは、指示薬の色の変わり方が、急激か徐々かに注目して下さい。
Aでは、フェノールフタレインが徐々に変色しており、弱塩基と強酸の滴定であることが分かります。(弱塩基と強酸の中和点は酸性側)
同様にCでは、メチルオレンジが徐々に変色しており、弱酸と強塩基の滴定であることが分かります。(弱酸と強塩基の中和点は塩基性側)
フェノールフタレインの変色域は塩基性側、メチルオレンジの変色域は酸性側なのでこう言えるのですが、滴定曲線と変色域を重ねた図があると一目瞭然なんです。
ということは、Aは弱塩基ですからNH
3、Cは弱酸ですからCH
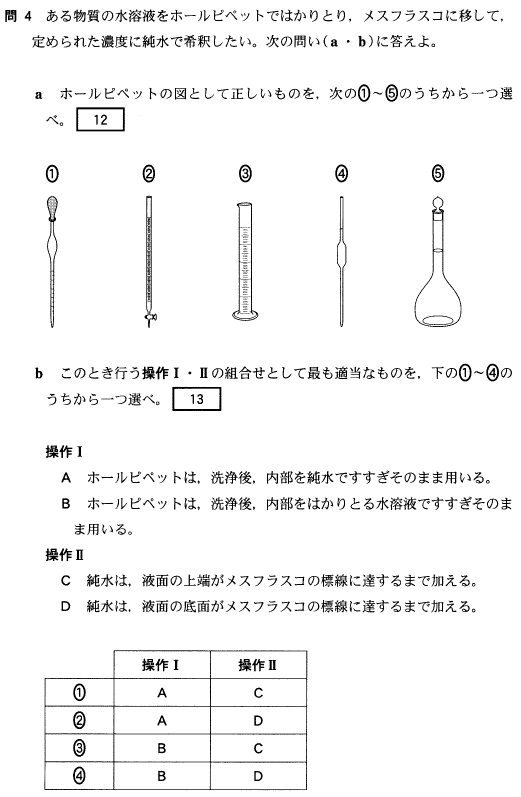
3COOHとなります。
3つめは、中和に要した液量に着目します。
A、Bは塩基と分かりましたが、化合物群の塩基はNH
3、KOH、Ca(OH)
2の3つです。
BはAの2倍量の酸で中和されたので、Aは1価の塩基、Bは2価の塩基Ca(OH)
2と考えられます。