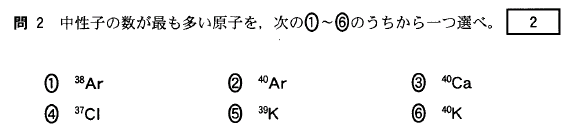
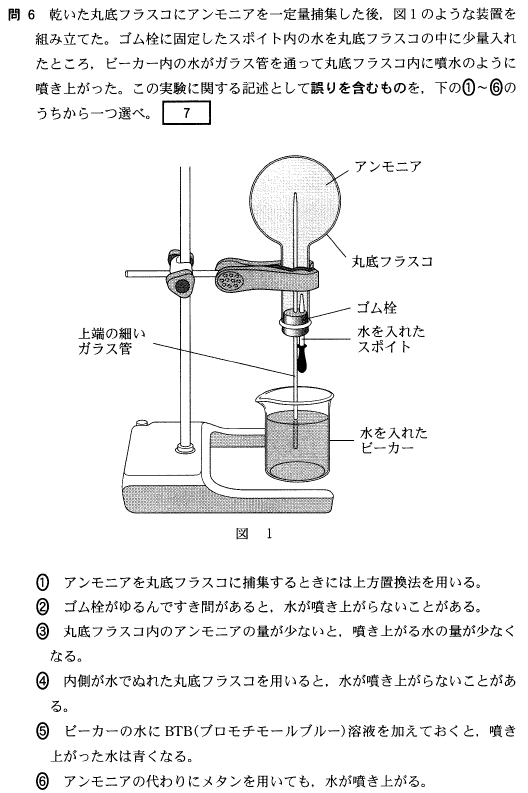
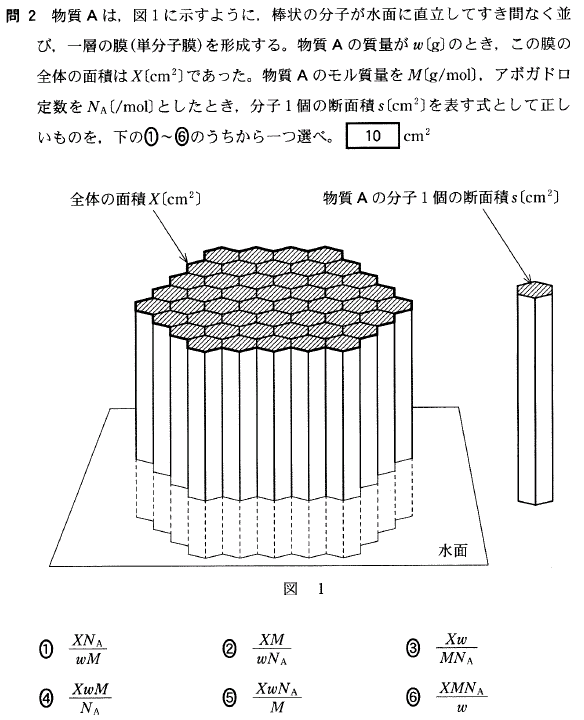
[9]正解①
普通に考えれば、4Lの水素、1Lのヘリウムの重さを計算する、となりますが・・・
H
2 = 2(g/mol)、He = 4(g/mol) ですから、
水素4(mol)、ヘリウム1(mol)、の体積で考える(水素22.4L×4、ヘリウム22.4L)
と、 2g×4/4g = 2 ですから、H
2 は He の 2倍重いとなり、
これは、水素4L、ヘリウム1Lの場合も同じであることが分かります。
(共に22.4Lで考えると、HeはH
2 の 4g/2g = 2倍重いことになりますから、水素がヘリウムの2倍の体積なら同じ重さになり、水素がヘリウムの2倍以上の体積なら水素の方が重くなると考えてもいいですね)
② CH
4=16(g/mol)より、このメタンは1(mol)でこの中のH原子は4.0(mol)
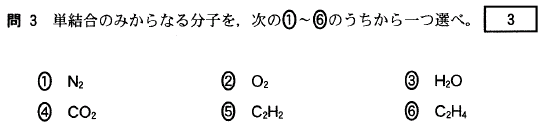
③ 25/(100+25) = 25/125 × 100 = 20(%)
④ NaOH = 40(g/mol)より、NaOH4(g)は、4/40 = 0.1(mol)
これが0.1(L)中にあるので、0.1/0.1 = 1.0(mol/L)