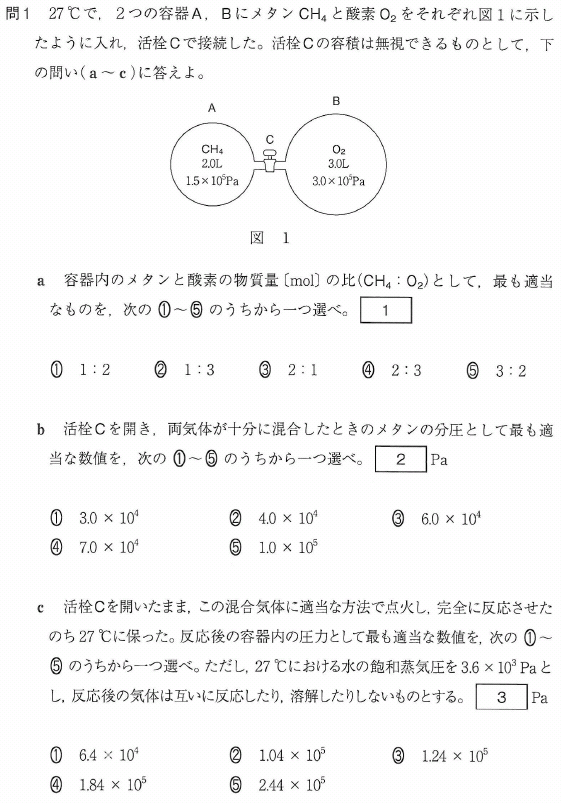
問1
a
状態方程式で各物質量を計算してもいいのですが、
CH4とO2を同一体積にした時の圧力で比較、又は
CH4とO2を同一圧力にした時の体積で比較、という手があります。計算早いです!
どちらも物質量の比が求められます。
では、CH4とO2を同一圧力3×105Paにした時の体積で考えてみましょう。
CH4は1L、O2は3Lですね。
ということは、CH4(mol): O2(mol)= 1 : 3 となります。いいでしょうか?
答[1]②
b
CH4の体積は2Lから5Lになったので、圧力は2/5 倍になります。
1.5×105Pa × (2/5) = 6×104Pa
答[2]③
c
CH4燃焼の反応式を書き、分圧(Pa)を記入してみましょう。
CH4 + 2O2 → CO2 + 2H2O
反応前 6×104 18×104
反応分 -6×104 -12×104 +6×104 +12×104
反応後 6×104 6×104 12×104
ここで、生じたH2Oについて考えてみましょう。(重要ポイントです!)
12×104Paとなっていますね? これは飽和水蒸気圧 3.6×103Pa を超えています。
このことから水蒸気は飽和状態で、この時の水蒸気圧は3.6×103Paだ ということです。
よって反応後の全圧は、
6×104 + 6×104 + 0.36×104 = 12.36×104 ≒ 1.24×105Pa
答[3]③

問1
a
Aの水素の体積が3Lから5Lになるだけです。
体積が5/3倍になるので、圧力は3/5倍になります。
ボイルの法則の式に入れずに、次のように計算するとちょとだけ早いですよ。
2×105×(3/5) = 1.2×105Pa
答[1]②
b
2つのコックD、Eを開いた後、
水素の分圧PH2は、
PH2=2×105×(3/6) = 1×105Pa
一方、全圧は 2×105Paですから、
気体Xの分圧PXは
PX + PH2 = 2×105Pa
∴PX = 1×105Pa
PH2: PX = 1:1 なので
H2とXが 1:1 で混合していることが分かります。
すなわち、H2とXの分子量の単純平均が17ということになります。
∴ (2+MX)/2 = 17
∴ MX = 32
分子量32になるのは、選択肢の中ではO2になります。
答[2]⑥

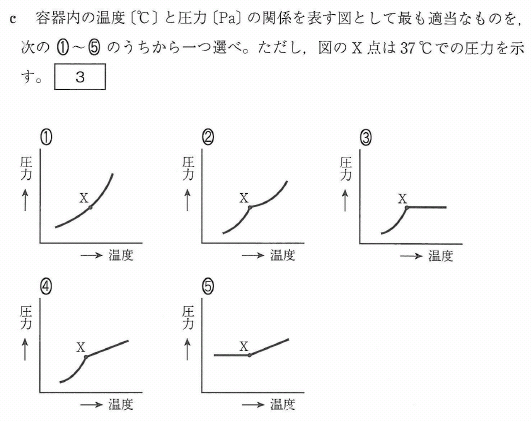
c
温度を上げていった時、ある温度までは気体と液体が共存し、
この時の気体の圧力は飽和蒸気圧ですから、
上の温度対圧力のグラフでは蒸気圧曲線として表されることになりますね。
次に、液体がすべて蒸発して気体になってしまえば、通常の気体のふるまいですから
温度対圧力のグラフは傾きが一定の直線として表されます。
よって、蒸気圧曲線に正の傾きの直線が接続されたグラフが正解です。
答[3]④

問1
a
37℃でちょうど液体がなくなった訳ですから、
化合物Aについて、
蒸気の圧力は飽和蒸気圧の2.57×104Pa、蒸気の体積は0.5L、蒸気の質量は0.77g です。
これを、状態方程式 PV = wRT/M に代入すると、分子量Mが求められますね?
M = wRT/PV
=0.77×8.3×103×310/2.57×104×0.5
≒154.2
答[1]②
b
20℃で気体になっている化合物Aの質量wは、状態方程式を用いて
w = MPV/RT
= 154 × 1.21 × 104 × 0.5/8.3 × 103 × 293
≒ 0.38g
よって、液化した化合物Aは
0.77-0.38 ≒ 0.39g
∴液化した化合物Aの割合は、
(0.39 × 0.77) × 100 ≒ 50.6%
答[2]②
20℃のAの飽和蒸気圧が1.21×104Paなので、
仮にですが、37℃→20℃の液化分を圧力で示してあげると
2.57×104-1.21×104=1.36×104Paです。
ですから、液化分の割合は
(1.36×104/2.57×104)×100 でいいんじゃない!?
これで計算すると、約53%となり答が違ってます・・・
このやり方スムーズでいいと思ったのに・・・
気づきましたか?
そうです。温度が変化しているんですね。
上の計算では、温度変化が圧力に反映されていないんですね。
ここからは一般的ではありませんが、
圧力の値を温度変化に対応した値に変えてやってみましょうか?
37℃での2.57×104Paは、20℃では2.57×104×(293/310)≒2.43×104Pa
この値を用いて37℃→20℃の液化分を圧力で示すと
2.43×104-1.21×104=1.22×104Paです。
∴液化分の割合は
(1.22×104/2.43×104)×100≒50.2% となりました!
(概数値で計算を続けているので、先ほどの答と少しずれていますが、
やり方は正しいです!)
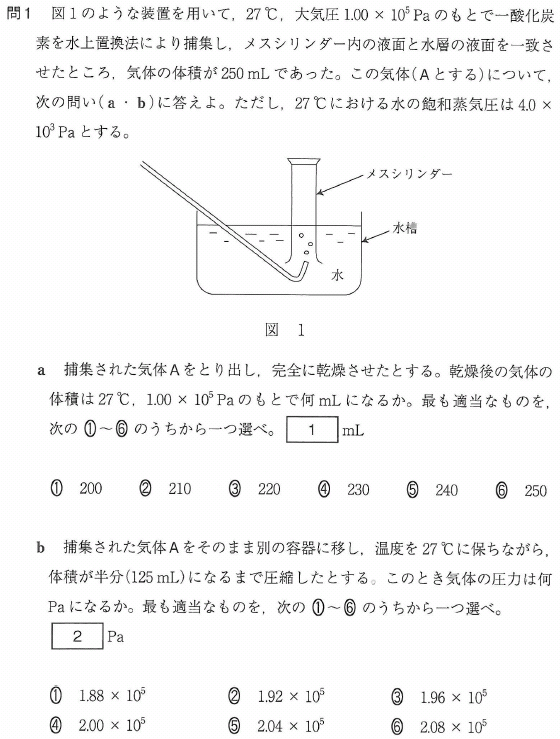
問1
a
水面を一致させているので、メスシリンダー内と外の気圧が同じになっています。
メスシリンダー内は水蒸気で飽和されていると考えて良いです。
メスシリンダー内のCOの分圧+水蒸気の分圧=大気圧 ですから
PCO=1×105 - 4×103
=1×105 - 0.04×105
=0.96×105
=9.6×104(Pa)
体積は250mLですね。
27℃、1×105Paのもとだと体積は何mL?
ボイルの法則の式に代入するのが普通ですが、次のやり方がちょっと早いです。
250mL×(9.6×104/1×105 )=240mL
「圧力と体積は反比例」を使いました。
答[1]⑤
b
体積を125mLつまり 1/2 倍に圧縮するのですから、
COの圧力は2倍になります。
しかし、水蒸気は元々飽和状態だったので、圧縮しても飽和状態です。
この時の水蒸気の圧力は27℃の飽和蒸気圧、つまり圧縮前と同じになります。
よって、圧縮後の全圧Pは
P=9.6×104×2 + 4×103
=1.92×105 + 0.04×105
=1.96×105(Pa)
答[2]③
圧縮しても圧力が変わらないってどういうこと? 水蒸気はどこかへいっちゃったの?
って思いませんか?
水蒸気の一部が水滴に変化したのです。
(温度に応じた)決まった量しか水蒸気になれない訳ですから
圧縮すると、一部水滴になっていき、水蒸気圧が保たれる、という訳です。
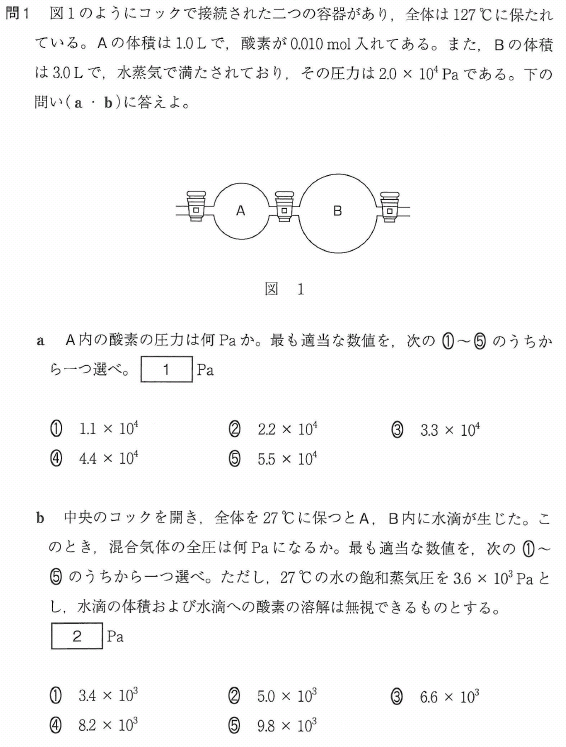
問1
a
コックはまだ開けられていません。容器Aの中だけで考えます。状態方程式を使います。
P=nRT/V
=(0.01×8.3×103×400/1.0)
≒3.3×104(Pa)
答[1]③
b
水滴が生じた状態なので、容器内は水蒸気で飽和している状態です。
ですから、この水蒸気の分圧は、飽和蒸気圧の3.6×103Paです。
一方、酸素の分圧は、
P=nRT/V
=(0.01×8.3×103×300/4.0)
≒6.2×103(Pa)
∴容器内全圧は、
3.6×103 + 6.2×103(Pa)=9.8×103(Pa)
答[2]⑤
さて、この問題では、水蒸気の分圧をどう考えるかがポイントです。
水滴が生じていれば、容器内は水蒸気が飽和している状態ですから、
この時の水蒸気圧は、その温度での飽和水蒸気圧(温度に応じた決まった値)になります。
蒸発できる量には限度があり、それ以上は蒸発できない訳です。
その時の水蒸気の圧力が飽和蒸気圧ということですね。
仮に水滴が生じていなければ、水蒸気が飽和していない状況ですから、
この時の水蒸気の分圧Pは、ボイルシャルルの法則で求めればいいのです。
計算してみましょうか?
2.0×104×3.0/400 = P×4.0/300 ですね。
P≒5.6×103Paとなりました。
この値は、飽和蒸気圧3.6×103Paを超えていますね。
飽和蒸気圧分を超えて蒸気にはなれないのですから
この時の水蒸気の圧力は3.6×103Paということになります。