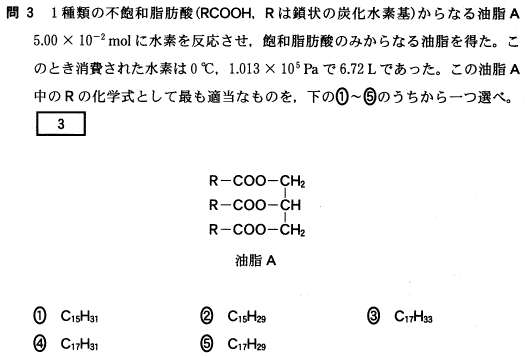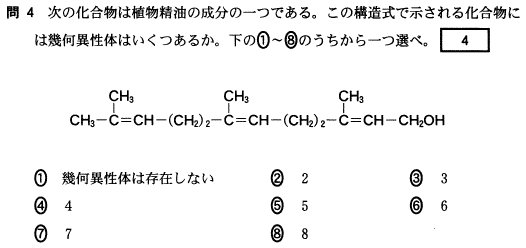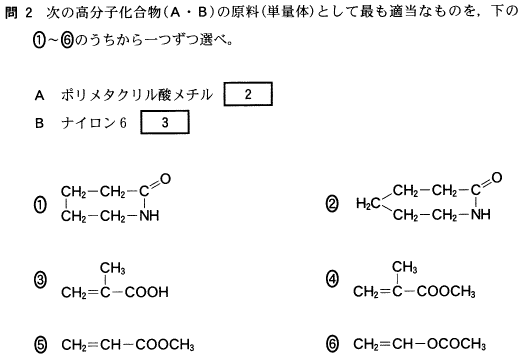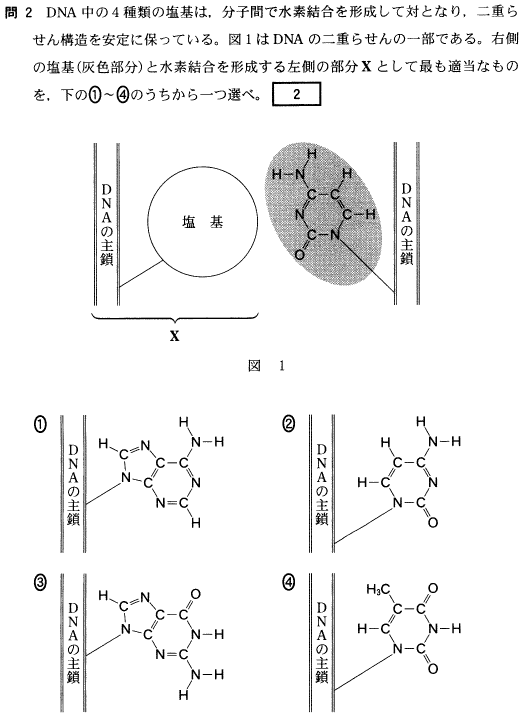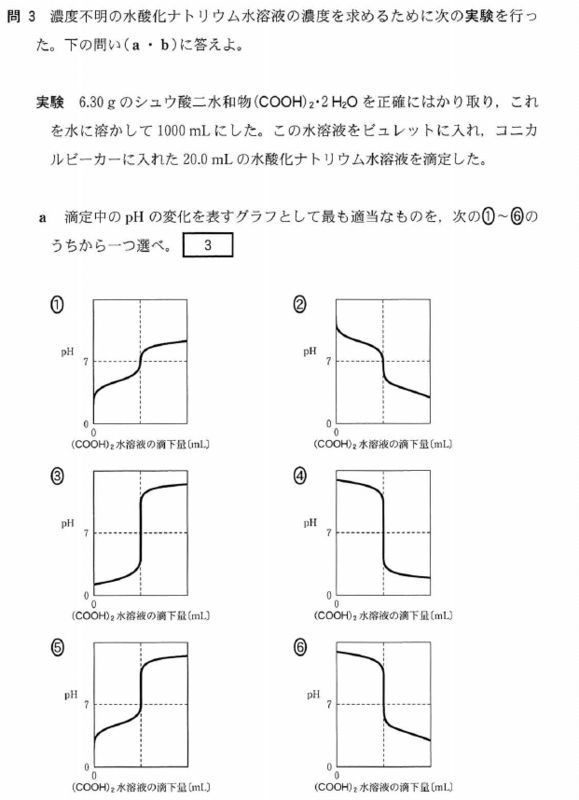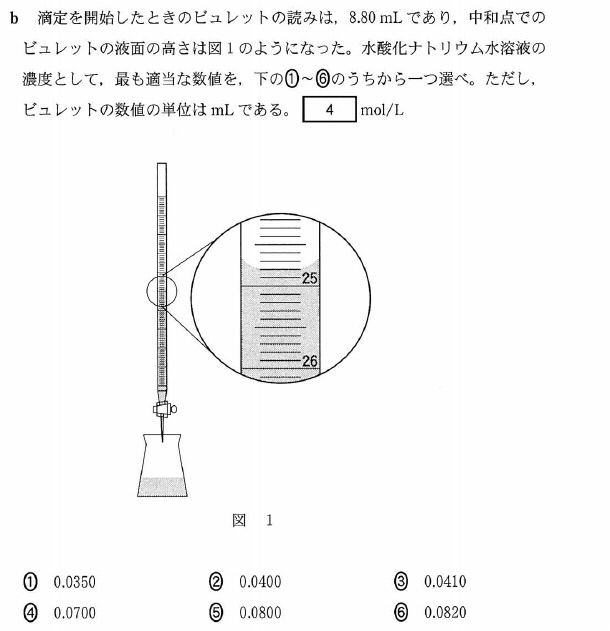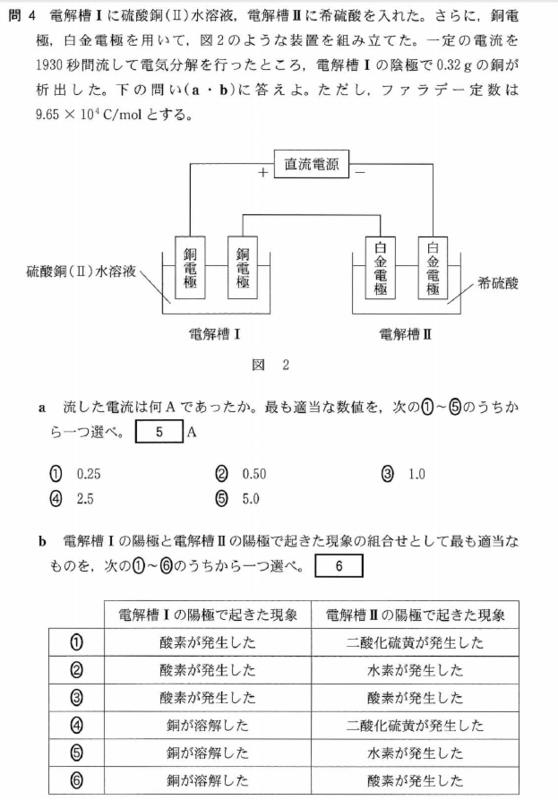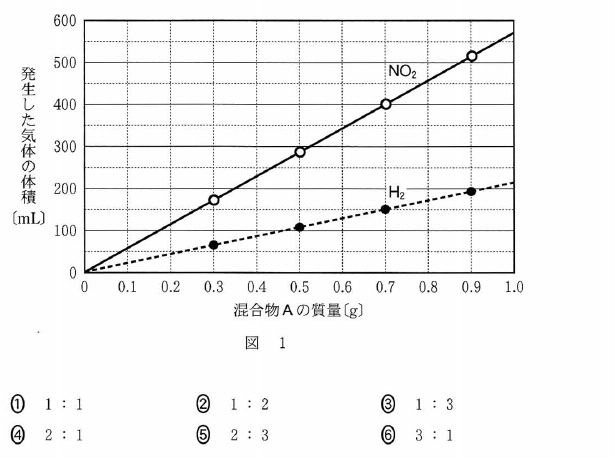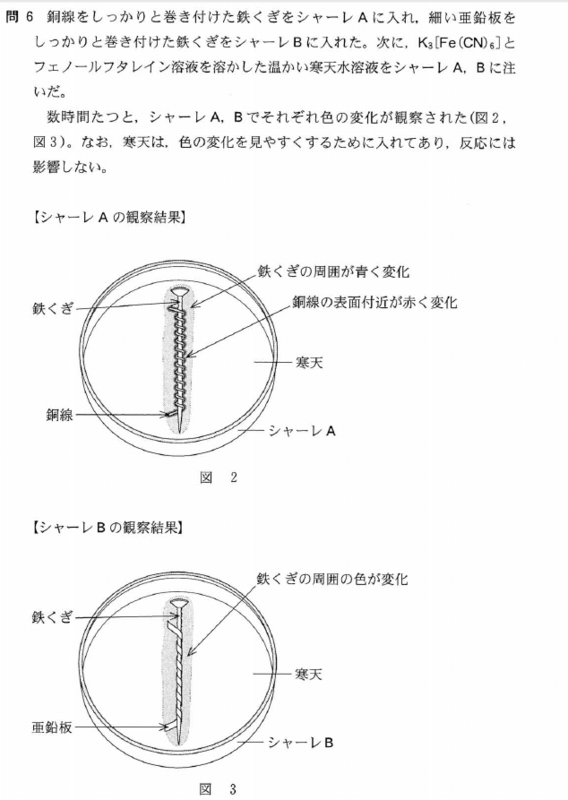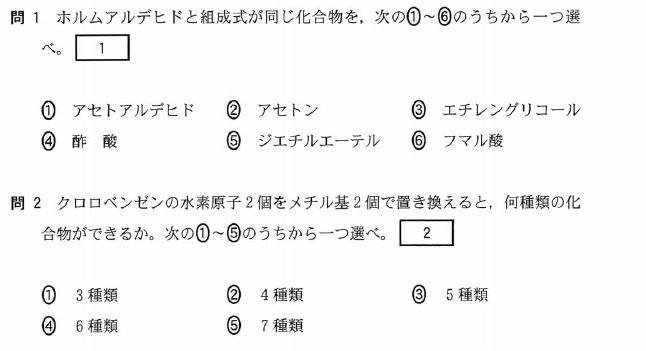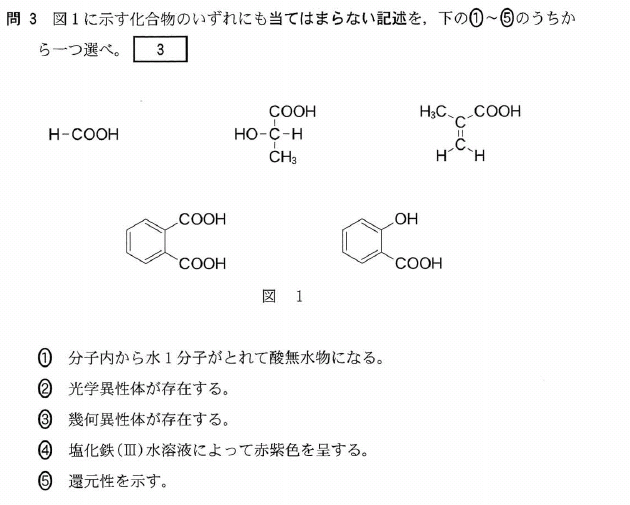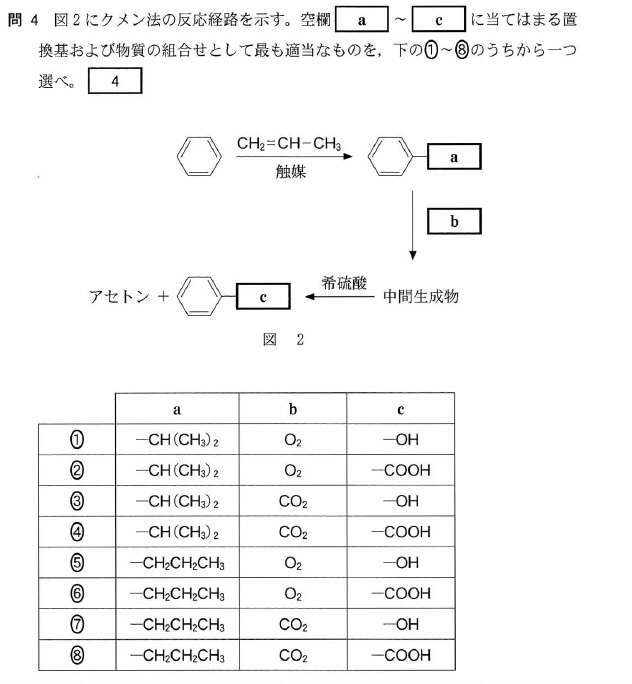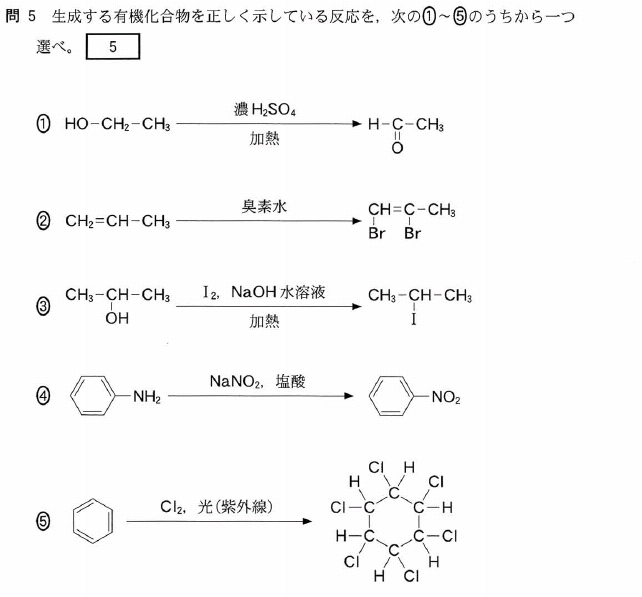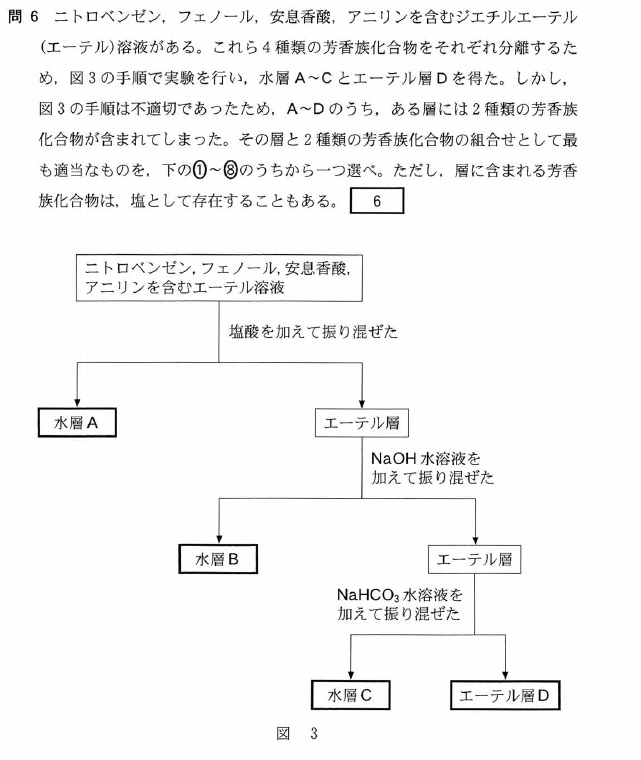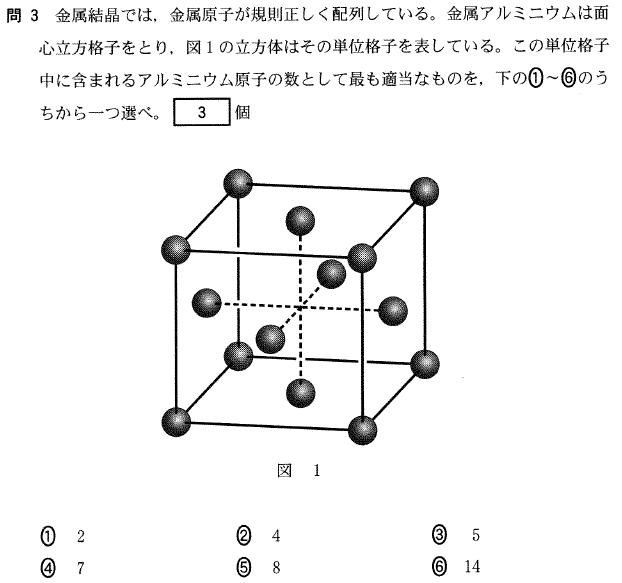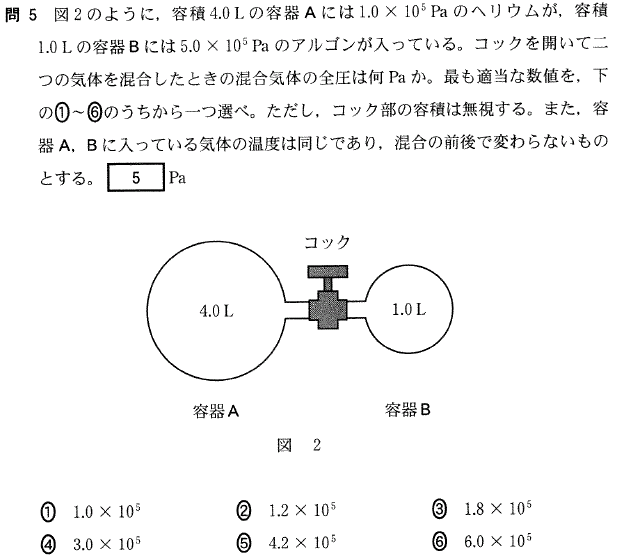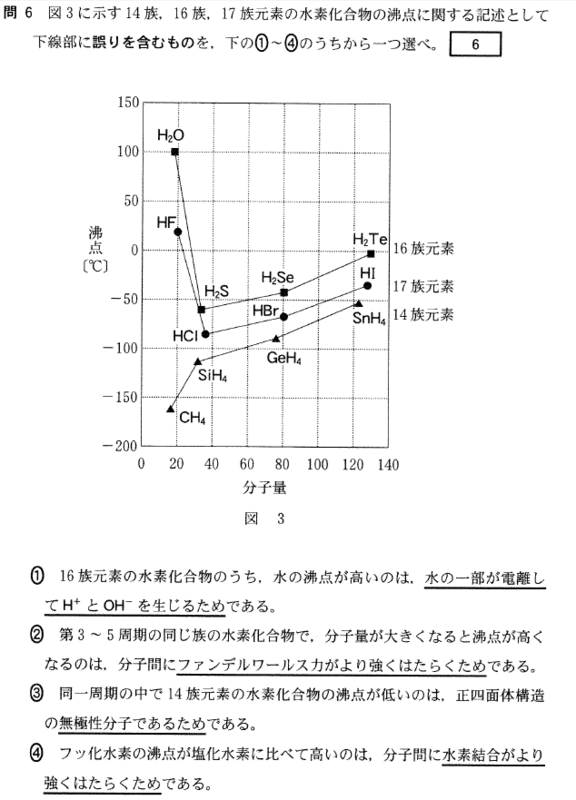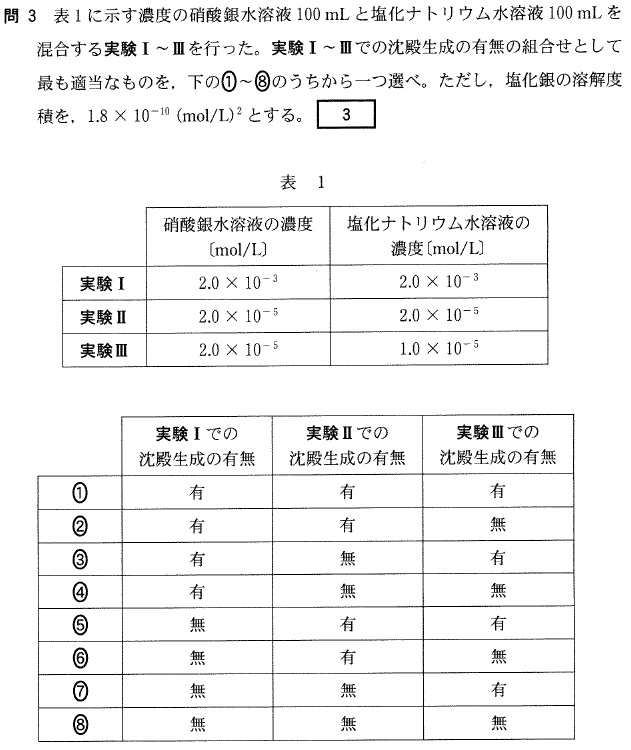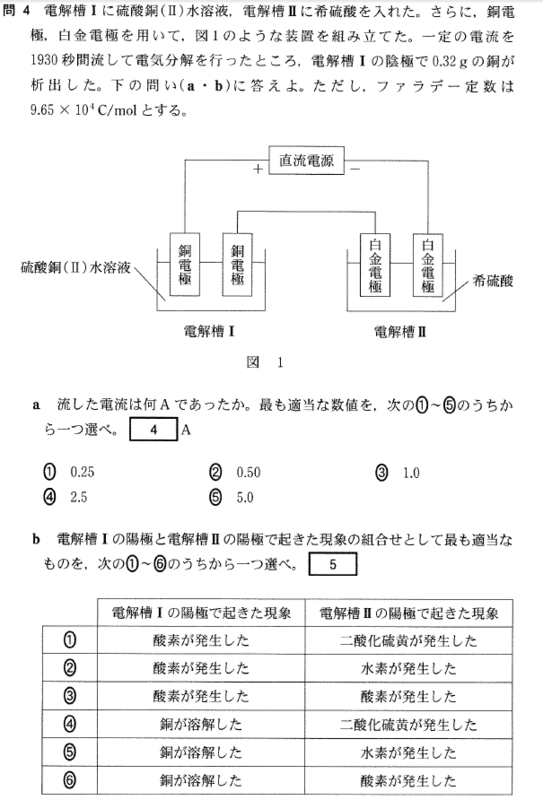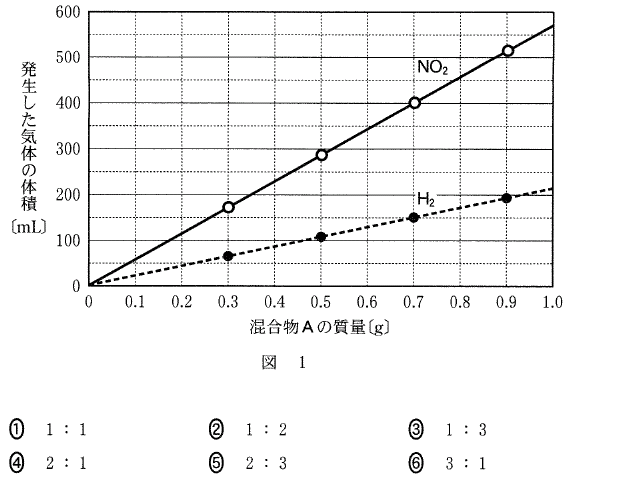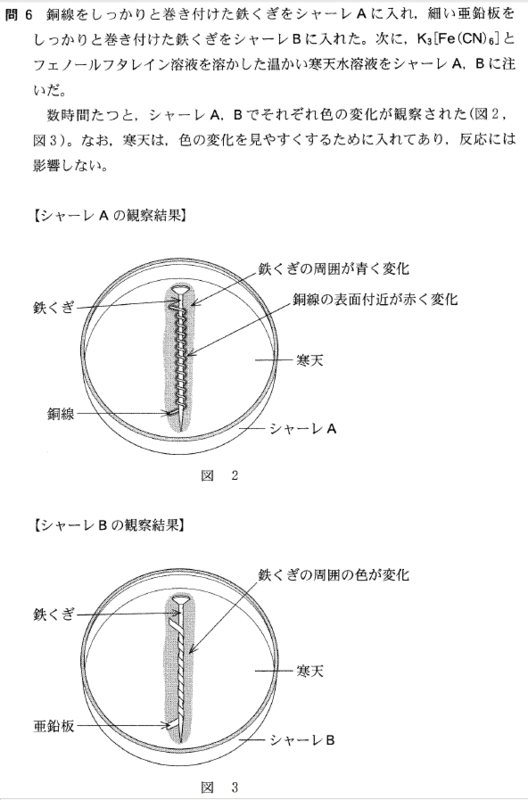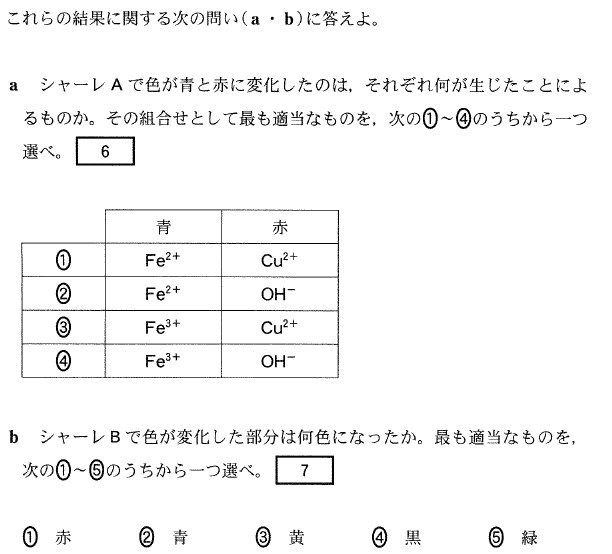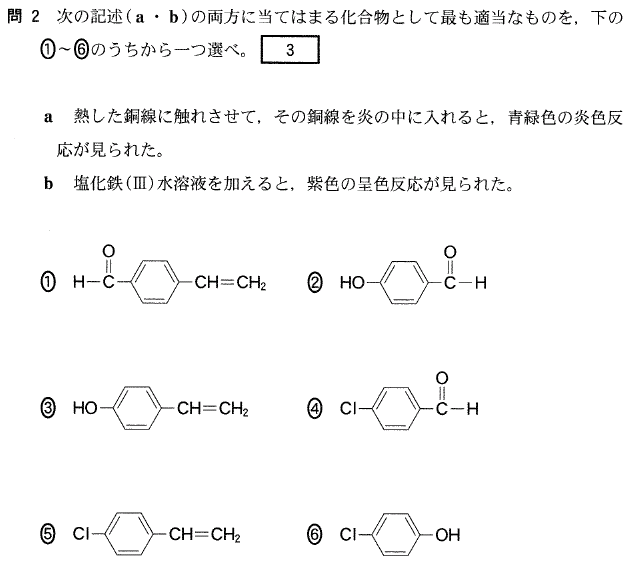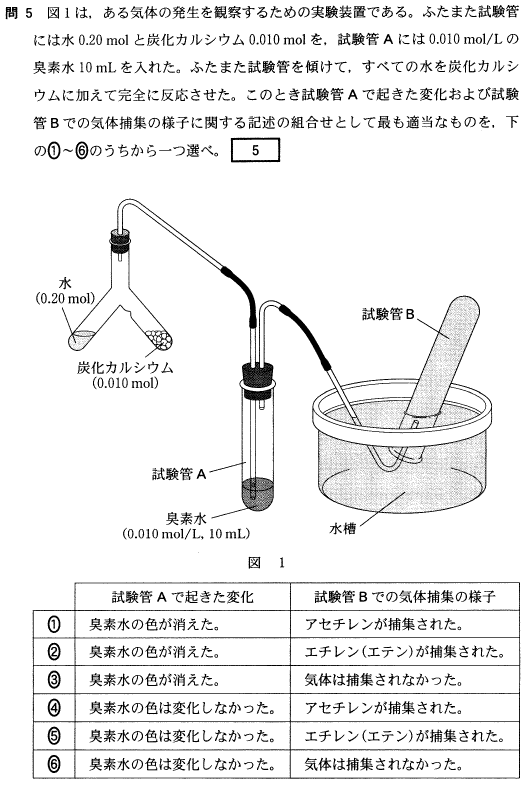
[5] ①
CaC
2 + 2H
2O → Ca(OH)
2 + C
2H
2 反応する水は過剰(0.02モル以上存在)なので、CaC
2はすべて反応します。
よって、C
2H
2は0.01モル生成。
このC
2H
2にBr
2が付加しますね。
Br
2は、0.01×0.01=0.0001モルあります。
C
2H
2 + 2Br
2 → C
2H
2Br
4 この反応では、Br
2に対してC
2H
2が過剰
(0.00005モル以上存在)ですから、
Br
2はすべて消費され、臭素水の色は消える、と考えていい訳です。
また、C
2H
2はすべて反応しませんから、未反応のC
2H
2が試験管Bに溜まりますね。
一部、CHBr=CHBrの生成も考えられますが、
この物質は分子量が大きく(Brの分が大きい)気体ではない、と考えていいです。
また、このCHBr=CHBrには色がない、と考えていいでしょう。
(臭素が付加した炭化水素、臭素で置換した炭化水素は無色、を思い出して下さい)
ですから、試験管Aは色のついた状態にはならない、と考えていいでしょう。