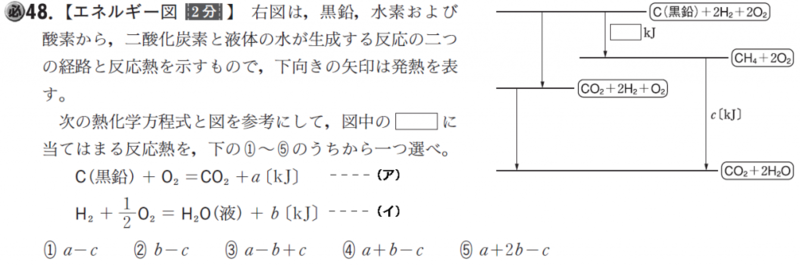
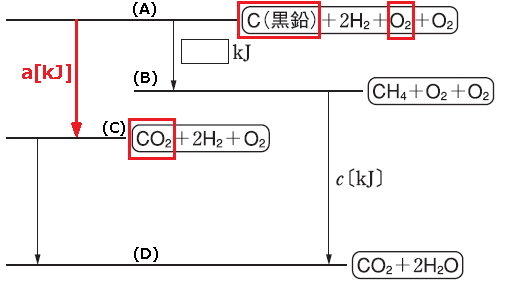
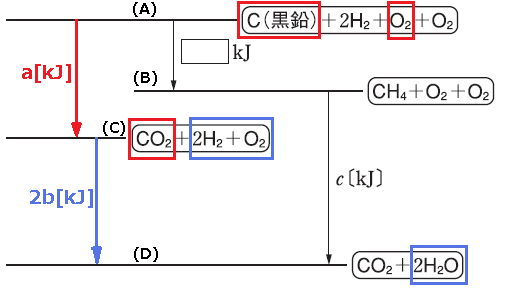
2種類以上の気体が混合していて、この気体を完全燃焼させると、CO
2とH
2Oが発生し発熱する ・・・ といった問題も定番です。

まず、化学反応式を書かなくちゃ、と思いますよね?
H
2 + C
2H
2 + 3O
2 = H
2O + 2CO
2 + 1600kJ
こういう風に書く生徒がとっても多いんです。またその気持ちも分からなくはありません。
でも、こう書いちゃいけないんですよ!
その理由ですが、
この反応式だと H
2 と C
2H
2 の係数が同じなので「H
2 と C
2H
2 は同じ物質量(mol)」と決まっちゃってる。 そこがいけない。 ということなんです。
(実は、この問題では H
2 : C
2H
2 = 1 : 1 なんですが、いつもこうとは限りません)
では、反応式はH
2 と C
2H
2 で別々に書きましょう。
また、H
2 と C
2H
2 の計1molなので、C
2H
2 Xmol 、 H
2 (1-X)mol 、 とおきます。
さらに、O
2 、 CO
2 については問われていないので、こんな風に書いてみましょう。
H2 →
H2O +
300kJ (1-X)mol (1-X)mol 300(1-X)kJ
C2H2 →
H2O +
1300kJ Xmol Xmol 1300XkJ
さて、発熱量の合計は800kJですので
300(1-X) + 1300X = 800
∴ X = 0.5mol
また、生じた水は、H
2 からの分 1-0.5 = 0.5mol 、 C
2H
2からの分 0.5mol で計 1mol。H
2O=18g/molですから、18g生じたことになります。
答 a ③ 、 b②