当サイトは、URLを変更しました。
新URL https://9monotaira.mydns.jp


当サイトは、URLを変更しました。
新URL https://9monotaira.mydns.jp
[1]正解⑤
この中に1種類の物質だけのものは、グルコースC6H12O6 しかありません。
以下には、入試には余計と思われる説明も入っていますが、
この問題では、純物質であるグルコースが一目瞭然ですから、悩まずに即断して大丈夫です。
①水に、塩化ナトリウム、塩化マグネシウム等が溶け込んでいる。
②水に、酢酸、アミノ酸等が溶け込んでいる。
③水に、塩化水素が溶け込んでいる。
④コンクリートは、砂や砂利にセメントと水を混ぜて固化させたものです。
セメントは、石灰石、粘土を高温で焼き、セッコウを混ぜたものです。
⑥青銅は、銅Cuと亜鉛Znを溶融して作った合金です。合金は一般的には混合物に分類しておけばいいでしょう。
(合金はやや複雑で、一般的には、化合物(金属間化合物)と混合物(固容体)が混合した状態ですが、入試では、この知識は問われません)
⑦銑鉄は、鉄に数%の炭素が主に含まれ、さらにケイ素、マンガン等が含まれる合金の一種と考えられますので、⑥と同様に混合物と考えればいいです。
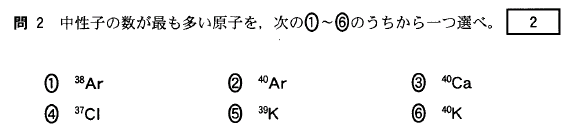
[2]正解⑧
典型元素の同族元素は、価電子数が同じですね。価電子数が最外殻電子数です(18族を除く)から、
16族の酸素Oと同族の硫黄Sを選びましょう。
①Alは13族で3個
②Cは14族で4個
③Clは17族で7個
④Liは1族で1個
⑤Mgは12族で2個
⑥Neは18族で8個
⑦Pは15族で5個
⑧Sは16族で6個
⑦Cは14族で4個
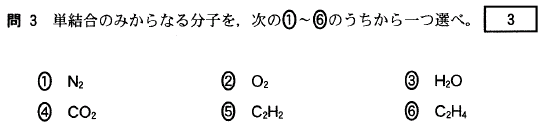
[3]正解⑥
分子が結晶になった時、その結晶はすべて分子結晶です。
①結晶は、構成粒子が規則正しく並んだ固体です。分子結晶での構成粒子は分子です。
②イオン結晶内のイオン結合は強いのですが、分子結晶内の分子間引力は非常に弱いため、
イオン結晶より分子結晶の方が融点が低くなります。
③これも、分子間引力が非常に弱いのが原因です。
分子結晶を加熱すると、液体を経ずに気体になってしまうものがあります。
④分子が、分子間力で規則正しく並んだ結晶が分子結晶です。
⑤分子結晶には、電気を導く粒子(電子、イオンなど)がないので、電気を導きません。
[4]正解④
同じ元素の原子どうしの結合には極性が無く、また、できた分子全体にも極性が生じません。
[5]正解②
異種元素の原子の結合には極性が生じますが、
CO2、CH4等の分子では、極性が打ち消しあって、分子全体では極性を持ちません。
この場合の「極性が打ち消しあう」とは、「正負の電荷の重心が一致する」ということです。
[6]正解③
38.96 × (100- x)/100 + 40.96 × x/100 = 39.1
38.96 × (100- x) + 40.96x = 3910
3896 - 38.96x + 40.96x = 3910
2x = 14
よって、
x = 7(%)となります。
39 × (100- x)/100 + 41 × x/100 = 39
と、およその値で計算すると、
x = 5(%)となって、ダメです!
与えられた値で真面目にやりましょう!
[7]正解⑥
銅Cuは遷移元素ですが、鮮やかな青緑色の炎色反応を示します。
この他、基本的に、アルカリ金属、アルカリ土類金属が炎色反応を示しますが、
Li、Na、K、Cu、Ca、Sr、Ba だけで大丈夫ですから、色をしっかり覚えましょう。
[8]正解①
ビタミンC(アスコルビン酸)には還元作用があり、酸化防止剤として食品に添加されています。
(また、ビタミンCは無色です)
②ステンレス鋼は、鉄に、ニッケル、クロム等の金属を加えて作る合金で、
名称の通り錆びにくい特徴があります。
③ プラスチック等の高分子化合物は、分子量の小さな分子を重合させて作ります。
④炭酸水素ナトリウムNaHCO3を加熱すると、容易に分解して、CO2の気体を発生します。
この性質が、ホットケーキ(パンケーキ)等の調理に利用されています。
⑤塩化カルシウムには、強い吸湿作用があり、除湿剤、乾燥材として用いられています。
⑥アンモニアNH3は、硫酸アンモニウム等の窒素肥料の原料に用いられています。
[10]正解③
分子量Mの分子1(g)は、
1/M (mol)で、これがN(個)ですから、
1 (mol)は、NM(個)となります。
また、分子量18の分子100(g)は、
100/18 (mol)ですから、分子の数は、
100/18 × NM = 100NM/18 (個)となります。
[9]正解④
各物質中の酸素の質量比を、それぞれ分数で表してみます。
① 2O/SiO2 = 32/60
② O/H2O = 16/18
③ 2O/CO2 = 32/44
④ O/N2O = 16/44
これらの比較ですが、分子をすべて 32 に揃えると簡単です。
① 32/60
② 32/36
③ 32/44
④ 32/88
ですから、この中の分母が最も大きい④が、最も割合が小さくなります。
物質1(g)とありますが、これは答を選ぶのに必要ないですね。
[12]正解①
(COOH)2・2H2O = 126(g/mol)より、(COOH)2・2H2O は、12.6/126 = 0.1(mol)
また、この中に(COOH)2 も、12.6/126 = 0.1(mol)あります。
水溶液全量が1(L)ですから、シュウ酸(COOH)2 のモル濃度は、
0.1(mol/L) となります。
② 1(mol/L)の塩酸10(mL)に水を加えて1(L)とする、なら正解です。
なら、この問題文も正しいのでは?
まず、1(mol/L)の塩酸10(mL)の密度は1ではないので、10(g)ではありません。
さらに、できた溶液は、10+990=1000(g)ですが、これも密度は1ではないので、1(L)ではありません。
そもそも、ある濃度のモル濃度の溶液を調整する時、溶媒だけの体積や質量を量って加えるということはしません。
③ pH = 2 にしたいということは、[H+]=10-2(mol/L) にすればいいのですから、これは正しいのでは?
いいえ。
0.1(mol/L)の H2SO4 中の [H+]は、0.2 (mol/L)ですから、これを10倍に薄めると、0.02 = 2 × 10-2 (mol/L)となり、pH は 2 より小さくなります。
④ 100(g)の水酸化ナトリウムに水を加えて1000(g)とすれば、正しい文章です。しかし、できる溶液の密度は 1 ではないので、水を加えて1(L)にすると1000(g)にはなっていません。





| 日 | 月 | 火 | 水 | 木 | 金 | 土 |
28 | 29 | 30 | 1 | 2 | 3 | 4 |
5 | 6 | 7 | 8 | 9 | 10 | 11 |
12 | 13 | 14 | 15 | 16 | 17 | 18 |
19 | 20 | 21 | 22 | 23 | 24 | 25 |
26 | 27 | 28 | 29 | 30 | 31 | 1 |